Neurofeedback temoignages
Neurofeedback & Le Syndrome Asperger (TSA)
Ruby Villar-Documet, l’expert Neurofeedback* qui « Rééduque le Cerveau » pour vous permettre une meilleure qualité de vie
Voici d'autres Témoignages de soins et de guérison de mes patients par ma méthode de traitement du Neurofeedback :
TDAH, TOCS, Insomnies, Instabilité Emotionnelle,… La Guérison de Mes Deux Enfants (Troubles orthophoniques, Troubles de l’Attention et la Concentration, Troubles de l’Obsession, Troubles du Sommeil, Troubles de l’apprentissage, Instabilité Emotionnelle, Troubles de Sociabilisation)
par la méthode de Neurofeedback de Mme Villar-Documet.
Témoignage Ny Ny.
Guéri des Troubles Anxieux associés aux Troubles de l’Attention (TDA)
par la méthode de Neurofeedback de Mme Villar-Documet.
Témoignage Valérie Le Berre
Guéri d'une Dépression Sévère et d'un Trouble de l'Attention
par la méthode de Neurofeedback de Mme Villar-Documet
Témoignage Thomas de Montalembert
Guérie de Dépression
par la méthode de Neurofeedback de Mme Villar-Documet.
Témoignage Sabrina Ghorki.
Guéri de mes Troubles Cognitifs et Burnout
par la méthode de Neurofeedback de Mme Villar- Documet.
Témoignage Pierre-Arnaud Nicolle-Malpas.
Soignée du Trouble Burn-Out , reprise des Capacités cognitives et du bien-être par la méthode de Neurofeedback de Mme Villar-Documet.
Témoignage Catnat.
Et encore, bien d'autres témoignages ....Le Traitement par Neurofeedback est aussi mis en place pour une large gamme de spectres et problématiques
… Des Compétences Cliniques d’Expert et un haut niveau de sophistication technologique, agissant sur un large spectre des problématiques ; avec des résultats ciblés et un haut degré de pertinence.
*Equipements Médicaux
-------*-------
Je suis Ruby Villar-Documet, psychologue et psychothérapeuthe d'orientation scientifique exerçant à Courbevoie aux portes de Paris, spécialiste des troubles psychiques et neurodéveloppementaux, et neurofeedback specialist.
Les résultats de mes traitements sont le fruit de l’application de « ma propre méthode de traitement par Neurofeedback » (Neurofeedback Excellence 1ère génération, qui fait participer trois systèmes différents de neurofeedback certifiés médicaux, qui vont s’enchainer dans le traitement a fur et à mesure des progressions du patient, ou ma méthode Neurofeedback Loreta) et tout particulièrement les relectures et analyses des séances que le patient vient de finir, ce qui donne lieu à de nouveaux ajustements après les séances, ainsi que de la mise en place d’un corollaire thérapeutique pour accompagner le traitement.
Prendre rendez-vous, aux portes de Paris, Courbevoie, France, avec Ruby Villar-Documet psychologue expert du traitement par Neurofeesback dans une large gamme des problematiques, merci de remplir le formulaire de contact.
-------*-------
Pour les Troubles Autistiques : ma méthode de traitement neurofeedback par de rétrocontôle, apporte les soins indispensables pour mieux vivre
A fortiori et avec des changements individuellement différents d’un patient à l’autre, le traitement permet une diminution ou disparition de plusieurs symptômes, il redonne une meilleure qualité de vie, un état de mieux-être, de calme et d'attention, de la concentration et de la confiance, une meilleure qualité de sommeil et une meilleure énergie. Nous faisons ici le point sur les dernières recherches et témoignages sur la question de la méthode du Neurofeedback, qui a permis de réduire les troubles autistiques chez l'enfant.
-------*-------
5 - Syndrôme Autistique et preuves du changement neurophysiologique suite au traitement par Neurofeedback.
Résultats d'études scientifiques et témoignages des parents sur les changements chez l'enfant : suite au traitement de la connectivité-guidée par Neurofeedback (biofeedback EEG)
Connectivity-Guided Neurofeedback (EEG Biofeedback) for Autism Spectrum Disorder: Evidence of Neurophysiological Changes
Robert Coben1,4*, Leslie Sherlin2, William J. Hudspeth3, Kevin McKeon1, Rachel Ricca4
1Neurorehabilitation & Neuropsychological Services, New York, USA (Institution where the study was conducted)
2Southwest College of Naturopathic Medicine, Arizona; and Nova Tech EEG, Arizona, USA
3Neuropsychometrix, California, USA
4Integrated Neuroscience Services, Arkansas, USA
*Address correspondence to: Robert Coben, Co-Director, Integrated Neuroscience Services, 86 West Sunbridge Drive, Fayetteville, AR 72703, USA. Email: drcoben@integratedneuroscienceservices.com
Copyright: © 2014 Coben et al. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (CC-BY).
- Résumé
- Introduction
- Méthode et Participants
- Matériaux
- L’équipements Neurofeedback
- L’échelle d'évaluation
- Procédure
- L'analyse des données- Résultats
- Discussion
- Recommandations
Résumé :
Des études récentes ont lié les déficits de cohérence neuronaux ayant une déficience associée à des troubles du spectre autistique (TSA). L'étude actuelle a testé l'hypothèse que l'abaissement de l'hyperconnectivité neuronal conduirait à une diminution des symptômes autistiques.
Les sujets ont subi un traitement sur la connectivité guidée Neurofeedback (biofeedback EEG), qui a prouvé qu'il améliorait le fonctionnement neuropsychologique et atténuait les symptômes autistiques.
Des réductions significatives de cohérence neuronale entre les régions fronto-temporales et les changements de puissance de la source localisée étaient évidentes dans les régions frontales, temporelles et limbiques après ce traitement.
En même temps, après le traitement, les sujets ont montré des améliorations significatives sur les tests neuropsychologiques ; les parents ont aussi déclaré et témoigné des gains positifs, tels que la diminution des symptômes après le traitement.
Ces résultats valident le traitement par Neurofeedback (biofeedback EEG) comme une modalité thérapeutique pour les enfants autistes et suggèrent que les changements dans les anomalies de cohérence peuvent être liés au mécanisme d'action.
Mots-clés: Neurofeedback (biofeedback EEG), l'autisme, les TSA, la connectivité, la cohérence, LORETA
Introduction :
Les Centers for Disease Control and Prevention indique maintenant que la prévalence actuelle des troubles du spectre autistique (TSA) est de 1 à 68 (CDC, 2014). En outre, le Département américain de l'éducation a indiqué que des 1992-1993 à 2001-2002 années scolaires, le taux d'autisme a augmenté de 528% et semble continuer à être à la hausse (Safran, 2008; Yeargin-Allsopp, Rice, Karapurkar, Doernbert , Boyle, et Murphy, 2003). Ganz (2006) a constaté que dans les États-Unis environ 3,2 millions $ sont dépensés pour soigner un seul individu atteint d’autisme au cours de sa vie, qui à son tour équivaut à un coût total de 35 milliards $ par année.
Au-delà des coûts monétaires, d'innombrables autres effets collatéraux sont ressentis par les membres de la famille qui prennent soin des personnes atteintes de TSA et par les individus eux-mêmes.
L'autisme est un trouble neurodéveloppemental caractérisé par une triade de déficience dans l'interaction sociale, la communication et les modèles restreints de comportement ou d'intérêts (APA, 1994). Les critères du Manuel diagnostique et statistique-quatrième édition (DSM-IV) indique que l'autisme ne peut pas être diagnostiquée avant trois ans; Cependant, une enquête récente a montré que les parents ont signalé des symptômes autistiques dès 18 mois et ont même demandé un traitement médical avant l'âge de deux ans (APA, 1994; Filipek et al., 1999). La gamme hétérogène de troubles envahissants du développement comprend les classements suivants: trouble autistique, le syndrome de Rett, l'enfance trouble désintégratif, le syndrome d'Asperger et le trouble envahissant du développement non spécifié (PDD-NOS, DSM-IV, APA, 1994).
Ces classifications se répartissent dans un large éventail de symptômes communs associés à des niveaux de gravité. La parole peut être inflexible et ne répond pas au contexte ainsi que limité à l'écholalie ou des sujets étroits d'expertise dans lequel le discours peut se poursuivre sans interaction conversationnelle (Belmonte, Beckel-Mitchener, Boulanger, Carper, et Webb 2004). De plus, les comportements sociaux sont souvent caractérisés par le manque d'interaction; jeu manque de coopération dans lequel l'enfant lui-même ou se borne généralement à jouer à la périphérie du groupe. En outre, l'imagination d'un enfant atteint de TSA est généralement déficient et l'individu se concentre étroitement sur des comportements répétitifs (Belmonte et al., 2004).
Les points récents de la recherche visent une théorie de la connectivité neuronale défectueuse comme un mécanisme sous-jacent les symptômes des TSA (Baron-Cohen, 2004;. Belmonte et al, 2004). –Connectivity, Peut être défini comme un certain nombre de moyens de mesure de la communication entre deux ou plusieurs emplacements de neurones dans le cerveau (Coben, 2007).
Rippon, Brock, Brown, et Boucher (2007) ont proposé un modèle de l'autisme associée à des déficits d'intégration de l'information résultant de la connectivité réduite entre les réseaux neuronaux locaux spécialisés et sur-connectivité au sein des assemblées de neurones individuels, notamment dans les lobes frontaux. Une over-connectivité, ou hyperconnectivité, se réfère à la communication excessive entre les emplacements de neurones dans le cerveau. Over-connectivité des ensembles neuronaux au sein et entre les lobes frontaux a été trouvée pour conduire à des perturbations dans l'intégration des informations provenant de l’affectif, du linguistique, du sensoriel, et des systèmes automatiques (Courchesne & Pierce, 2005). Mizuno, Villalobos, Davies, Dahl et Muller (2006) ont constaté en l'utilisant des données IRMf, que les individus atteints de TSA ont des zones de connectivité excessif dans de nombreux endroits neuronaux, notamment les régions frontales postcentral et moyenne, ainsi que l'insula gauche. De même, Buxhoeveden, Semendeferi, Schenker et Courchesne (2004) a rapporté des preuves que l'autisme est un trouble de la connectivité excessive dans les lobes frontaux, qui influe à son tour la connectivité neuronale entre le cortex frontal et d'autres systèmes cérébraux.
Diffusion Tensor Imaging (DTI) étude sur des sujets atteints de TSA ont révélé des preuves des anomalies neurales suivantes: l'augmentation des volumes de la substance blanche cérébrale dans le cortex frontal, anormalement petites minicolonnes dans la zone frontale, et anormalement longues épines dendritiques présentes dans des densités élevées.
La Résolution variable tomographie électromagnétique (Vareta) montre des images de patients atteints de TSA avec activité également accrue dans le cervelet, le thalamus, hippocampe, gyrus parahippocampal, Cuneus, cingulaire, et linguales, ainsi que dans le temps, précentral, postcentral, pariétal et occipital régions corticales ( Coben, Chabot, & Hirschberg 2013). Tous les éléments de preuve ci-dessus sont indicatif d'un dysfonctionnement frontal compatible avec hyperconnectivité pour les sujets atteints de TSA (Barnea-Goraly et al., 2004;. Herbert et al, 2004; Buxhoeveden et al., 2004; Semendeferi et al., 2004; Belmonte et al., 2004).
Preuves et témoignages d'améliorations, par la méthode thérapeutique du neurofeedback :
Il a été récemment émis l'hypothèse que la réduction de hyperconnectivité neuronal dans le cerveau autiste peut conduire à des améliorations dans les domaines tels que, l'attention, les fonctions d'autorégulation, le comportement social, et les compétences de communication, mais sans s'y limiter (Coben & Myers, 2008).
Cantor, Thatcher, Hrybyk et Kaye (1986) ont informatisé et analyse l’ EEG de 11 enfants atteints de TSA entre les âges de 4 et 12 ans, contrairement aux trois autres groupes d'enfants: (a) 88 enfants normaux, (b) une correspondance groupe de 18 enfants handicapés mentaux, et (c) un groupe de 13 enfants en bas âge normaux appariés selon l'âge mental. L’analyse Électroencéphalographie (EEG) a fourni des données en temps réel de l'activité électrique neuronale dans plusieurs régions avec une excellente résolution.
Les résultats indiquent que les enfants atteints de TSA avaient significativement : Une plus grande cohérence entre les hémisphères dans la bande bêta que les handicapés mentaux, les enfants normaux, ou les tout-petits normaux. Les enfants du groupe autiste avaient une cohérence plus élevée dans la bande alpha que ceux qui vivaient dans le groupe normal, et avaient une asymétrie moins interhémisphérique et intrahemispheric que les participants du groupe normal ou handicapés mentaux. La Coherence est un moyen de mesure de connectivité basée sur des données EEG et représente un calcul mathématique spécifique de la corrélation croisée entre les deux formes d'onde dans une bande de fréquence.
Ces résultats semblent indiquer que l'EEG est un moyen utile de mesure et qui valide les anomalies de cohérence dans cette population.
Poursuivant, Murias, Webb, Greenson et Dawson (2007) a utilisé l'analyse EEG pour évaluer la connectivité dans les 18 adultes atteints de TSA par rapport aux 18 témoins sains adultes dans les états de repos avec les yeux-fermés. Leurs résultats ont montré qu'il y un niveau score relatif élevé, de cohérence dans le groupe ASD, en particulier dans l'hémisphère gauche dans une bande basse fréquence (thêta). Dans la gamme alpha inférieure (8-10 Hz), avec une portée de cohérence réduite pour le groupe ASD dans les régions frontales, et entre les régions frontales et tous les autres endroits du cuir chevelu (Murias et al., 2007).
Ces résultats constituent un motif de plus, en appui aux hypothèses de connectivité et sous-connectivité dans le cerveau de sujets atteints de TSA.
Coben, Clarke, Hudspeth, et Barry (2008) ont comparé 20 enfants avec et sans ASD, appariés avec le sexe, l'âge, et le QI. Les résultats ont suggéré des dysfonctionnements des sites frontaux et postérieurs comme motifs des anomalies de cohérence. Coben et al. (2013) ont étudié 91 enfants atteints de TSA et les a comparé à 91 enfants normaux. Les résultats ont montré des différences pour EEG dans la puissance, l'asymétrie et la cohérence. Il y avait une combinaison des deux hyper- et hypocoherence avec une grande cohérence dans les régions frontales et avec de faibles cohérences entre les régions cérébrales postérieures et temporelles.
Notre commentaire sur ces preuves et témoignages en tant qu'expert en neurofeedback :
Des recherches préliminaires suggèrent que le Neurofeedback (biofeedback EEG) peut être une forme de thérapie efficace pour réduire les symptômes de l'autisme chez les enfants (Coben & Padolsky, 2007; Jarusiewicz 2002).
Le Neurofeedback (EEG biofeedback) permet au clinicien d’apprendre au cerveau à travailler d'une manière nouvelle, plus efficace grâce à l'utilisation des paradigmes sous-jacents du conditionnement opérant.
Ce traitement consiste à fournir un sujet un feedback‖ visuelle et auditive pour certains comportements neuronaux (Monastra, Monastra, & George, 2002). Par le conditionnement, le sujet apprend à inhiber les fréquences d'EEG qui sont excessivement générés (hyperactivité) et à augmenter les fréquences qui sont déficients (hypoactivité).
Avec le traitement à travers le Neurofeedback et l’accompagnement thérapeutique, le patient apprend à constituer son traitement de l’information d’ondes cérébrales simultanées avec un fonctionnement neuronal sain.
Récemment, Walker, Kozlowski, et Lawson (2007) ont présenté des preuves démontrant la capacité thérapeutique du Neurofeedback pour apprendre avec succès le fonctionnement neural d’états plus normatif, tout en montrant simultanément la réduction des symptômes autistiques.
Pour plus d'informations détaillées au sujet du Neurofeedback (biofeedback EEG) le lecteur intéressé peut consulter les travaux d’ Hammond (2007).
L'efficacité du Neurofeedback (biofeedback EEG) pour les enfants autistes a été initialement évaluée par Jarusiewicz (2002), dans lequel elle a obtenu une diminution de 26% des symptômes autistiques dans le groupe expérimental et une réduction de 3% dans un groupe témoin.
En outre, le Neurofeedback, peut commencer à améliorer la qualité de vie des autiste au cours de quelques mois de thérapie ; n'a pas d'effets démontrables secondaires, et est utile pour un large éventail de troubles, y compris le TDAH, l'épilepsie, la dyslexie, et d'autres domaines de fonctionnement (Leins et al., 2007; Hammond, 2007; Lubar, Swartwood, Swartwood, & O'Donnell, 2005; Egner & Sterman, 2006; Evans & Park 1996
Dans notre étude précédente (Coben & Padolsky, 2007), nous avons présenté des preuves de l'efficacité dans le traitement de la connectivité par Neurofeedback (EEG biofeedback) pour les TSA. Les parents ont annoncé des résultats positifs, avec une amélioration clinique dans 89% (33 sur 37 sujets) du groupe expérimental. Ce taux était significativement différent du groupe témoin dans lequel 83% des parents n’ont rapporté aucun changement. Surtout, aucun des sujets conformant les deux groupes n’ont rapporté aucune aggravation des symptômes autistiques.
Les évaluations faites par des parents sur le traitement d'évaluation avec la grille de l'autisme (ATEC; Rimland & Edelson, 2000) ont montré une diminution de 40% dans les principaux symptômes de l'autisme suite au traitement avec le Neurofeedback dans le groupe expérimental. Les diminutions des symptômes autistiques ont également été trouvé sur l'échelle de l'Gilliam Asperger (GADS; Gilliam, 2001), Gilliam Autism Rating Scale (GARS; Gilliam, 1995), Inventaire de personnalité pour les enfants, deuxième édition (PIC-2; Lachar, et Gruber, 2001), et le comportement Note Inventaire des fonctions exécutives (BREF; Gioia, Isquith, Guy & Kenworthy, 2000).En comparaison, aucun de ces changements étaient évidents dans le groupe témoin liste d'attente. Enfin, en quant aux symptômes neuropsychologiques (avant et après le traitement) de l'attention, la perception visuelle, la langue, et le fonctionnement exécutif ont révélé une augmentation de la performance neuropsychologique du groupe expérimental, autant qu'une amélioration d'un écart type par domaine, à la fin de l’étude.
Dans la présente étude, nous élargissons sur ces constatations antérieures en présentant des données relatives à des changements dans le fonctionnement du cerveau. Source des changements localisés au pouvoir du traitement de la cohérence. Nous émettons l'hypothèse que la connectivité traitée par Neurofeeback (biofeedback EEG) est une thérapie capable de changer le cerveau autiste d'une manière thérapeutique. Nous supposons en outre, que la réduction hypercoherence neuronal sous-tend l'efficacité clinique revue ci-dessus dans cette approche.
Méthode et Participants :
Trente-sept enfants atteints de TSA ont été accueillis pour cette étude dans le groupe expérimental, tandis que 12 enfants ayant reçu également reçu un diagnostic de TSA ont était accueillis dans le groupe témoin « liste d'attente ». Les groupes ne différaient pas significativement en termes d'âge, de sexe, de race, d'impartialité, d'autres traitements, ou de la gravité des TSA comme indiqué par le ATEC. Le groupe expérimental a reçu au moins 20 sessions de traitement par Neurofeedback (EEG biofeedback) connectivité, tandis que le groupe témoin « liste d'attente » n'a reçu aucun traitement expérimental. Enfin, le consentement nécessaire éclairé a été obtenu et toutes les procédures ont été bien expliquées aux parents pour que leurs enfants participant à l'étude.
Le groupe expérimental comprenait 31 hommes et 6 femmes avec des âges allant de 3,92 à 14,66 ans avec un âge moyen de 8,92 ans. Ce groupe contenait 36 Caucasiens et un Américain asiatique. Parmi le groupe expérimental 56,8% (n = 21) ont été diagnostiqués avec PDD-NOS, 18,9% (n = 7) avec l'autisme, 13,5% (n = 5) avec le syndrome d'Asperger, et 10,8% (n = 4) avec désintégratif de l'enfance désordre. Le groupe témoin « liste d'attente » inclus 10 hommes et deux femmes avec des âges allant de 5,83 à 10,92 ans avec un âge moyen de 8,19 ans
Matériaux :
La collecte de données EEG ont été recueillie, pour évaluer les différences de cohérence dans cette étude. Les données EEG ont été obtenues sous deux conditions, les yeux fermés et les yeux ouverts. Un bonnet d'électrode étirable intégré avec 19 capteurs fixés sur le cuir chevelu a été utilisé pour recueillir des données, en référence frontale, sol préfrontal, et les oreilles liées. Chaque enregistrement a duré 20 minutes, où 10 minutes ont été utilisées pour chacune des deux conditions (yeux fermés et yeux ouverts). Les données d’artefacting ont été recueillies et traitées manuellement, ainsi que l’analyses des mesures de cohérence multivariée / connectivité dans NeuroRep (Hudspeth, 1999).
En outre, le système d'analyse neurométrique (NxLink 2001; John, Prichep, Fridman, & Easton, 1988) et Neuroguide (Thatcher, Walker, Biver, Nord, et Curtin, 2003), utilisés, sont tous deux, approuvés par la FDA, ils ont été utilisés pour analyser le puissance absolute, la puissance relative, et la cohérence (Thatcher et al., 2003). La fiabilité et la validité de l'EEG quantitative (EEGQ) ont été suffisamment évaluée et confirmée (Thatcher et al., 2003).
L’enregistrement EEGQ impliqué et la numérisation des lectures d'EEG ont été fait sur la base du Système international (10/20) de positionnement des électrodes utilisant le Deymed Diagnostic (2004) TruScan 32 Système d'acquisition EEG. Ce système comprend 32 canaux avec échantillonnage à 128 cycles par seconde et le filtrage entre 0,1-40 Hz. Tous les enregistrements ont été effectués avec une impédance inférieure à 5 kOhms. Le rapport de réjection en mode commun de ce système est de 102 dB et le mode de rapport de réjection d'isolation est de 140 dB.
L’analyse EEGQ compare mathématiquement un EEG lecture individuelle à des échantillons normatifs appariés pour l'âge et le sexe. Grâce à cette analyse dans le fonctionnement neuronal, des incohérences EEG ont été localisées et explorées. En outre, l'analyse QEEG a fourni des descripteurs fiables de l'activité du cerveau normatif (John et al., 1988). Les analyses EEGQ ont été effectuées à la fois avant et après le traitement de la connectivité fait par Neurofeedback (biofeedback EEG).
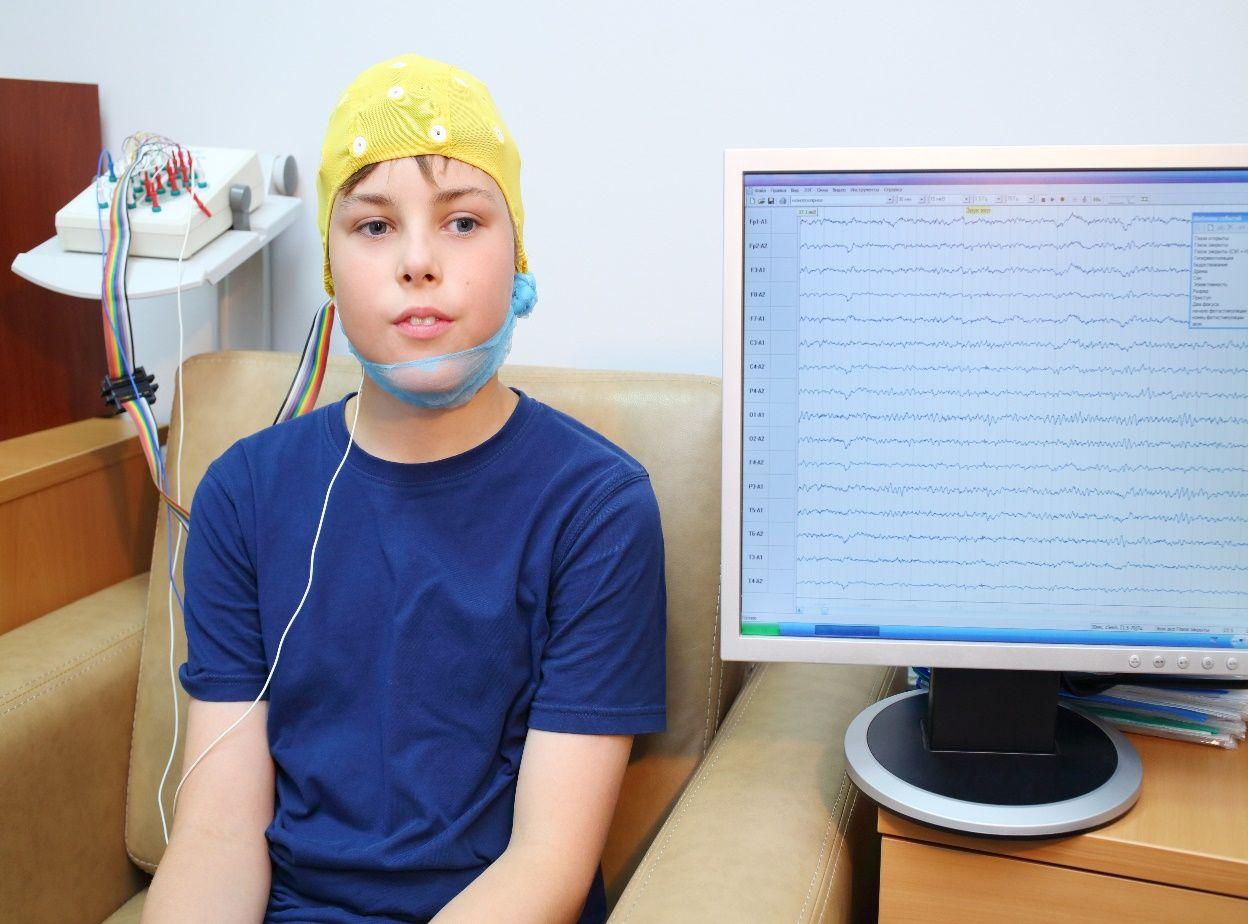
L’équipements Neurofeedback :
Nous avons utilisé l’EEGer NeuroCybernetics (NeuroCybernetics Inc., 2006) pour effectuer le traitement par Neurofeedback (EEG biofeedback) de la connectivité. Les capteurs (Grass Argent Disc 48 Electrodes avec des bornes protégées SafeLead; Herbe SafeLead, 2006) ont été appliquées sur le cuir chevelu du sujet pour mesurer l'activité EEG. Le signal a été ensuite renvoyé sous forme visuelle et sonore en fonction des valeurs relatives d'amplitude / de seuil. La rétroaction visuelle composée de graphiques simples (présentés sous forme de jeux d'ordinateur), offrant un affichage continu du rapport d'amplitude au seuil pour chaque flux de données. La récompense sonore est composée d'un fichier sonore pré-enregistrée d'un petit quart d'un second signal sonore, se produisant pas plus souvent qu'une fois par chaque demi-seconde d’activation lorsque les bonnes conditions spécifiques d'amplitude / cohérence ont été atteints (NeuroCybernetics Inc., 2006).
Le traitement a été personnalisé pour chaque individu sur la base de ses conclusions EEGQ de la cohérence. Basé sur l'analyse EEGQ de chaque participant, les zones montrant une hypercohérence la plus importante ont été ciblées pour le traitement. L’analyse EEGQ a été faite comparant les données EEG individuelles d'un participant à des données normatives indicatives des facteurs tels que l'âge, le sexe, etc.
Par exemple, sur la base du pré-traitement analyse EEGQ, nous avons trouvé un patient avec une hypercoherence maximale dans la région frontale droite principalement dans alpha. Un protocole a été conçu pour ce patient pour récompenser alpha (la gamme de fréquences de hypercohérence maximale) et d'inhiber l'activité EEG fréquence inférieure et supérieure au niveau des sites d'électrodes F8 / F7. Ceci a été réalisé en augmentant ou en récompensant l'amplitude de l'EEG entre les capteurs EEG séquentiels sur le cuir chevelu dans la gamme de fréquences de hypercoherence maximale.
L’amplitude EEG, peut être définie comme la différence entre les fréquences mesurées à partir d'un site actif et du capteur de référence. Par conséquent, l'augmentation de l'amplitude EEG (différence) implique la diminution de cohérence (similarité) entre les sites d'électrodes EEG. Ceci est le point crucial de l'application de la connectivité-Neurofeedback (biofeedback EEG) comme un moyen de diminuer l’hypercoherence chez les enfants atteints de TSA. Par ailleurs, cette amplitude a été choisie pour le traitement en raison de la relative facilité de manipulation, comme décrit ci-dessus. Pour une discussion plus approfondie sur la personnalisation des protocoles, le lecteur intéressé peut lire Coben (2007) (eLORETA) Exact Résolution Basse cerveau Tomographie électromagnétique (eLORETA) est une tomographie fonctionnelle qui utilise des données EEG pour créer des tranches en trois dimensions de l'activité neurale mettant en évidence les zones d’hypoactivité et suractivité (Pascual-Marqui, 1999). A partir de ces tranches d'image en trois dimensions de la matière grise corticale, le clinicien traitant avec le Neurofeedback peut mieux évaluer l'activité du cerveau en profondeur, au-delà de l'EEG détectable à la surface. Pour localiser ces différences de puissance, que nous avons choisi eLORETA, qui est la troisième édition du système LORETA.
eLORETA est actuellement considéré comme la version la plus exacte, et a été évalué et jugé être l’outil d’excellence pour localiser les différences de puissance du cerveau (Pascual-Marqui, 2007). En outre, la validité empirique d’eLORETA a été suffisamment étayée (Pascual-Marqui, Esslen, Kochi, et Lehmann, 2002).
L’échelle d'évaluation :
GARS est une liste de contrôle du comportement. Cette échelle est composée de quatre sous-tests (Comportements stéréotypés, Communication, interaction sociale et de développement). Les « Perturbations » sont mesurées par 14 items. L'échelle a été normée sur un échantillon de 1092 enfants et jeunes adultes (âgés de 2 à 28) à travers 46 états américains, le District de Columbia, Puerto Rico et au Canada. Les coefficients de fiabilité de cohérence interne pour tous les sous-tests et le total Quotient autisme vont de 0,88 à 0,96. La stabilité ou un test-retest varie de 0,81 à 0,88 pour tous les sous-tests et le total du Quotient autistique. Pour la « pré » et la « post » évaluation du traitement des personnes atteintes de TSA, les résultats doivent indiquer des niveaux élevés de stabilité. La validité de « construction » a été confirmée par des analyses qui constatent que: -Les éléments des sous-échelles sont représentatives des comportements associés à l'autisme.
-Les scores obtenus avec GARS, sont fortement liés les uns aux autres et à la performance sur d'autres tests de dépistage de l'autisme.
-Les scores GARS ne sont pas liés à l'âge.
-Les individus avec d'autres diagnostics ont des scores différents sur les GARS.
Le GARS est une échelle faite pour différencier les sujets entre autistes et non autistes avec un taux de précision de 90%.
GADS est une échelle d'évaluation comportementale. Le GADS se compose de 32 articles répartis en quatre sous-échelles, y compris: l'interaction sociale (10 articles), Patterns Restreint de Comportement (8 items), Patterns cognitifs (7 items), et les compétences pragmatiques (7 items). Le GADS a été normé sur un échantillon de 371 individus (âgés de 3 à 22; les hommes [n = 314], les femmes [n = 57]) diagnostiqués avec le syndrome d'Asperger à travers 46 États américains, le District de Columbia, Canada, Grande-Bretagne, Mexique, en Australie, et d'autres pays. Les coefficients internes de fiabilité de cohérence variaient de 0,87 à 0,95 pour le trouble de Quotient totale Asperger à travers des échantillons d'enfants avec et sans handicap identifiés. La fiabilité test-retest pour le trouble de Quotient du syndrome d'Asperger est 0,93 (p .01). Ces résultats indiquent que le GADS a un niveau élevé de stabilité pour une utilisation en tant que mesure de traitement pré-post des personnes atteintes du syndrome d'Asperger. La validité conceptuelle a été indiqué par des analyses constatant que: les scores GADS sont peu liés à l'âge; les « articles » sur les sous-échelles sont représentatives des comportements associés à la maladie d'Asperger; personnes avec d'autres diagnostics marquent différemment; scores GADS sont étroitement liés les uns aux autres et de la performance sur d'autres tests de dépistage de troubles graves du comportement; et le GADS peut différencier entre les personnes atteintes du syndrome d'Asperger et les personnes ayant des troubles du comportement. Le GADS a un taux de précision de 83% dans la différentiation de sujets non-Asperger (Gilliam, 2001) et le syndrome d'Asperger.
Procédure :
Une entrevue de diagnostic a été menée avec les parents pour déterminer les problèmes émotionnels fondamentaux comportementaux, cognitifs et sociaux / de préoccupation dans le cadre d'une histoire neurodéveloppemental complète. En outre, tous les participants impliqués dans cette étude répondaient aux critères soit: le trouble autistique, le syndrome d'Asperger, le trouble désintégratif de l'enfance, ou PDD-NOS comme décrit par le DSM-IV (APA, 1994). Un second critère d'inclusion pour cette étude était les scores de GADS et GARS. Seuls les sujets avec un score déterminant le profil « d'Asperger » ont été admis.
Le Quotient de 70 ou plus sur le GADS ou le Quotient d’autisme de 70 ou plus sur les GARS ont été utilisés dans cette étude.
Tous les participants ont subi une analyse EEGQ avant le début du traitement par Neurofeedback (EEG biofeedback) de connectivité guidée, ils n’ont pas moins de 20 sessions de traitement. Le EEGQ réalisé avant le traitement de la connectivité guidée par Neurofeedback (biofeedback EEG) a été fait afin d'évaluer les niveaux de référence de l'hyperconnectivité, de la cohérence et de la puissance. Encore une fois, cette ligne de base est évaluée en comparant analytiquement les données EEG individuelles de chaque participant à un EEGQ normatif avant le traitement. Sur la base de cette analyse, des protocoles de Neurofeedback (biofeedback EEG) personnalisés ont été conçus de manière à réduire de façon optimale et efficace la hypercoherence dans chaque sujet. L’analyse EEGQ effectuée après le traitement par Neurofeedback (biofeedback EEG) de connectivité guidée a été utilisée en tandem, avec l’analyse des conditions préalables, pour évaluer les changements importants.
L'analyse des données :
La Source-localisée de mesures (eLORETA) a été utilisée pour identifier « le pouvoir absolu » comme la première série de variables dépendantes. En ce qui concerne la collecte de données EEG, avec les matrices moyennes, croisées spectrales, ont été calculées pour les bandes delta (2-3,5 Hz), thêta (4-7,5 Hz), alpha (8-12,5 Hz), bêta (13-21 Hz), basse fréquence (2-7 Hz), haute fréquence (13-32 Hz), alpha1 (8-10 Hz), alpha2 (10-12 Hz), beta1 (12-16 Hz), beta2 (16-20 Hz), beta3 ( 20-24 Hz), beta4 (24-28 Hz), et beta5 (28-32 Hz).
Pour chaque bande de fréquence et dans les deux groupes, les modules de densité de courant à chaque voxel (amplitude de densité de courant) ont été lissées avec un filtre à moyenne mobile à trois dimensions, normalisée, et enfin log-transformées. L’identifiant et les estimations de puissance ont été systématiquement effectués en EEG et eLORETA à rapprocher les données gaussianité (John, Prichep, & Easton, 1987). Avec eLORETA, un certain lissage a été conseillé afin de réduire les erreurs anatomiques et de localisation dues à des différences inter-individuelles dans la géométrie de la tête et le placement des électrodes. En général, le maximal local a été visualisé dans des endroits légèrement différents.
La normalisation spatiale consiste à normaliser la racine carrée de la somme des valeurs actuelles au carré de densité pour chaque sujet à tous les voxels à l'unité égale. Cette manipulation élimine les variables confondantes telles que la variabilité inter-individuelle de l'épaisseur du crâne et de l'impédance d'électrode, sans contraindre l'analyse sur les mesures relatives de puissance. Les estimations d'amplitude de densité et de courant, ont été calculées et prétraitées comme décrit dans l’analyse statistique.
Pour comparer l'amplitude de la densité de courant des deux conditions, nous avons utilisé la randomisation-permutation comparaison multiple t-max approche (Congedo, Finos, & Turkheimer, 2004) qui a été récemment utilisée par Sherlin et al. (2007). Les approches Data-permutation d’adaptabilité ont pris compte de la structure de corrélation des variables, une fonction intégrée de toutes les mesures électrophysiologiques (Holmes, Blair, Watson, et Ford, 1996). Nous avons effectué un test pour chacune des régions passe-bande 13 fréquence (delta, thêta, alpha, bêta, basse fréquence, haute fréquence, alpha1, alpha2, beta1, beta2, beta3, beta4 et beta5). Pour l'ensemble de données (2,394 x 9 variables), voxel par voxel du t-tests ont été calculés; c'est le t-test pour les dessins appariés.
La moyenne de la pré-condition (A) est comparée à la moyenne de la post-condition (B). Les individus dans les deux conditions sont les mêmes. Le test statistique est l'étudiant-t bien connu, avec des valeurs positives indiquant moyenne (A)> moyenne (B), et les valeurs négatives indiquant moyenne (A)
Les variables eLORETA pour chaque sujet dans chaque groupe (formation pré-post) matrices croisées spectrales ont été calculées et en moyenne sur les époques de 4 secondes résultant en une matrice spectrale croisée pour chaque sujet et pour chacune des fréquences discrètes dans chaque bande.
Sur la base des analyses de Loreta précédentes (Lubar, Congedo, & Askew, 2003), nous avons utilisé une fenêtre rectangulaire. Fenêtres coulissantes se chevauchent (se chevauchent 93,8%) qu’ont permis des estimations spectrales fiables et lisses. Le progiciel LORETA-Key (Pascual-Marqui, Michel, et Lehmann, 1994) a été utilisé pour calculer LORETA densité de courant dans le domaine des fréquences directement à partir de la matrice spectrale croisée moyenne (Frei et al., 2001). Cette mise en œuvre de LORETA intègre un modèle de tête sphérique 3-shell enregistré reconnues anatomiques dans l’atlas du cerveau (Talairach & Tournoux, 1988), et fait usage de l'EEG électrode coordonnées dérivée de cross-enregistrement entre la géométrie de la tête sphérique et réaliste (Towle et al., 1993 ). L'espace de solution est limitée à la matière grise corticale en utilisant l'atlas de probabilités numérisées du Centre d'imagerie cérébrale de l'Institut neurologique de Montréal (Collins, Neelin, Peters, et Evans, 1994), divisé en 2.394 voxels mesure 7 x 7 x 7 mm)
Pour analyser la cohérence, les groupes de matières ont été préparés d'abord dans le programme NeuroRep NDAC. NDAC permet à l'utilisateur d'identifier et de sélectionner un sous-ensemble pour calculer les indices de connectivité premières pour les 171 combinaisons par paires de 19 électrodes, chacune comportant cinq bandes de fréquence: delta (0,5 à 3,5 Hz), thêta (3,5-7 Hz), alpha (7- 13 Hz), bêta (13-22 Hz) et totale (bande passante de l'amplificateur), puis calculer 171 groupe final signifie, les écarts-types, skewness et kurtosis. Une fois que les groupes ont été préparés, le programme statistique a été utilisé pour comparer les tester avec des changements significatifs dans la cohérence.
Comparer permet à l'utilisateur de calculer des t-tests de Student corrélation entre les indices de connectivité moyenne pour 171 combinaisons d'électrodes appariées (de NDAC). La signification des probabilités t-test a été évalué avec des méthodes de découverte de taux de faux (Benjamini & Hochberg, 1995;. Miller et al, 2001) pour contrôler les multiples erreurs de comparaison. Tous les indices de connectivité peuvent être éventuellement amélioré gaussant de la distribution résultant Fischer transformé z. La bande totale limitée fait référence à une bande passante de l'amplificateur EEG de 0,5-40 Hz. bandes passantes de filtres récursifs se réfèrent à quatre bandes exigea: delta (0,5-3,5 Hz), thêta (3,5-7 Hz), alpha (7-13 Hz), bêta (13-22 Hz).
Le programme compare les moyens, en utilisant des corrélations de Pearson et de t-tests corrélés. En outre, la normalisation des valeurs de connectivité peut être obtenue en utilisant la transformation z score de Fisher. En outre, comparer les comptes d'erreur de comparaison multiple par l'utilisation False Discovery Rate (FDR; Benjamini & Hochberg, 1995) des valeurs de seuil pour juger de la signification. Les indices de connectivité ont été calculées avec le logiciel provenant des programmes de -COHER écrits par Michael Hrybyk (Thatcher, Krause & Hrybyk, 1986) et ont été largement utilisés dans le logiciel EEG informatisé commercial: Quantitative Imaging Signal, NeuroRep, NeuroData, Lexior et NeuroGuide. Les routines mettent en oeuvre l'équation rapportée dans Bendat et Piersol (1980) et ils incluent les résultats d'un étalonnage de l'enregistrement EEG. À la connaissance des auteurs, tous les programmes commercialisés, produisent des résultats identiques aux résultats de Coher pour le fichier de calibration EEG. Dans cette équation, les signaux sont normalisés sur l'ensemble du dossier pour réduire au minimum l'influence des amplitudes de signal et de ce fait mettent l'accent sur la relation entre le couple de profils (EEG Bendat & Piersol, 1980). Les valeurs produites par comparaison (cohérence des analyses) étaient un deuxième ensemble de variables dépendantes pour cette étude.
Résultats :
Il y avait des différences significatives entre les résultats score de « puissance absolue » pré et post-traitement dans des sources localisées. La statistique t maximale, ou t-valeur maximale dans l'ensemble du volume, pour chaque bande de fréquence suit en puissance absolue ont des t-valeurs significatifs: delta (-2.63), thêta (-2.43) et basse fréquence (-2,57).
Les figures 1 à 4 illustrent les différences statistiquement significatives entre les deux conditions dans le pouvoir absolu ainsi que la région du Brodmann (Brodmann, 1909/2005) étiquette du voxel avec des différences maximales. La densité de la source de courant eLORETA est affichée dans la bande de fréquences des données.
Les coordonnées et les valeurs de t pour le voxel différent maximal, sont imprimées au-dessus l'image de la section sagittale. Toutes les statistiques t qui sont positives (hyper) sont affichées en rouge (la moyenne de post-condition est supérieure à la moyenne de la pré-condition). Toutes les statistiques t qui sont négatifs (hypo) sont affichés en bleu (la moyenne de la post-condition est inférieure à la moyenne de la pré-condition). Affichées sont les (à droite) des sections horizontales (à gauche), sagittal (milieu) et coronale à travers le voxel avec maximal statistique t. En outre, les erreurs associées à des comparaisons multiples ont été comptabilisées par notre mise en œuvre de la randomisation-permutation comparaison multiple t-max approche (Congedo et al., 2004). Seuls les résultats significatifs (images) sont affichés (Reportez-vous aux figures 1 à 4)
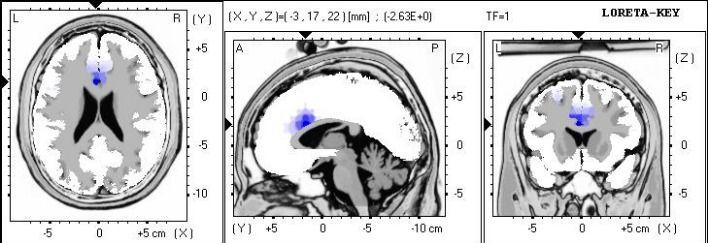
Figure 1. Analyse sLORETA montrant la localisation de source de puissance delta absolu.
Des différences significatives localisées à la zone Brodmann 33, cingulaire antérieur, et le lobe limbique.
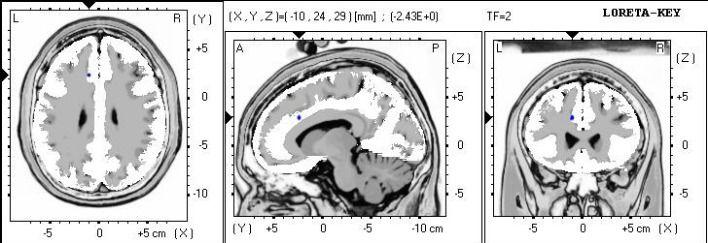
Figure 2. Analyse sLORETA montrant la localisation de source de puissance thêta absolue.
Des différences significatives localisées à la zone Brodmann 32, cingulaire antérieur, et le lobe limbique.
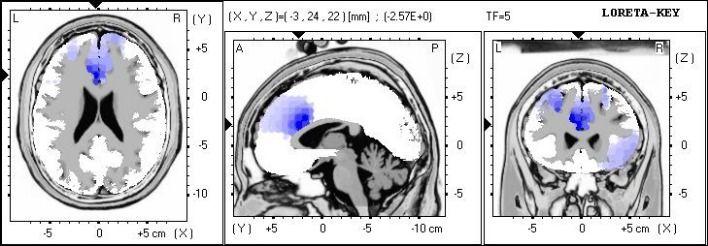
Figure 3. Analyse sLORETA montrant la localisation de source du pouvoir absolu des basses fréquences.
Des différences significatives localisées à la zone Brodmann 24, cingulaire antérieur, et le lobe limbique.
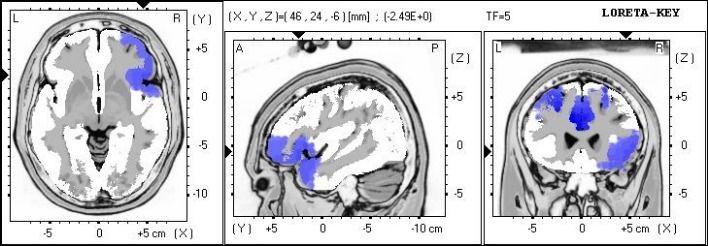
Figure 4. Analyse sLORETA montrant la localisation de source du pouvoir absolu des basses fréquences.
Des différences significatives localisées dans les zones Brodmann 10 et 47, gyrus frontal et lobe frontal.
Les différences significatives entre le pré et post-conditions ont été localisées avec une diminution de l'activité des ondes lentes (2-7 Hz) dans le cortex cingulaire antérieur et le gyrus frontal droit.
Les résultats les plus forts de diminution de l'activité lente ont été trouvés dans les zones de Brodmann 32 et 33 qui sont situés dans la zone corticale associative des lobes frontaux, qui participent à des réseaux corticaux préfrontaux, et qui sont censés régir le comportement personnel et social, l'émotion et de décision décision (Salloway, Malloy, et Duffy, 2001; & Courchesne Pierce, 2005).
L'aire de Brodmann 24 est située dans la zone corticale associative dans la partie antérieure du gyrus cingulaire. Cette zone est une composante corticale du système limbique qui est impliqué dans le traitement des émotions, le contrôle des expressions faciales, et les dimensions affectives de la douleur (Williams, Blanc, et Mace, 2005). En outre, le pouvoir absolu, a diminué en fréquence faible dans les zones Brodmann 10 et 47 de l'hémisphère droit. Cet espace se trouve dans la zone corticale associative dans la région préfrontale antérieure polaire des lobes frontaux et participe à des réseaux corticaux préfrontaux qui régissent les fonctions exécutives (Koechlin & Hyafil, 2007).
Les pré-groupes de notre étude ont été préparés et générés en NDAC en base aux données EEG. Les différences entre ces groupes, en termes de valeurs de cohérence, ont été analysées dans le paquet statistique Comparer. Ce programme statistique a fait des comparaisons entre les 171 moyens appariés en utilisant des corrélations de Pearson et mise en corrélation des tests t.
Deux-files de probabilités ont été utilisées pour les tests t appariés dans le delta, thêta, alpha, bêta bandes, et à travers la fréquence totale ainsi que des indices FDR ont été utilisées pour contrôler les erreurs dues à des comparaisons multiples (benjamini & Hochberg, 1995). Résultats bleus indiquent une diminution de la connectivité, alors que les résultats rouges indiquent une augmentation de la connectivité. Les figures 5 à 7 montrent, les analyses statistiques indiquant de nombreuses réductions significatives de la connectivité entre les sites neuronaux principalement dans les bandes alpha et bêta, ainsi que dans la cohérence totale.
La figure 5 montre l'analyse statistique des valeurs de bande alpha. Onze paires d'électrodes se sont révélées avoir une diminution significative de la connectivité neuronale à l'intérieur de cette bande, tandis que seulement une paire se révèle avoir une augmentation significative de la connectivité.
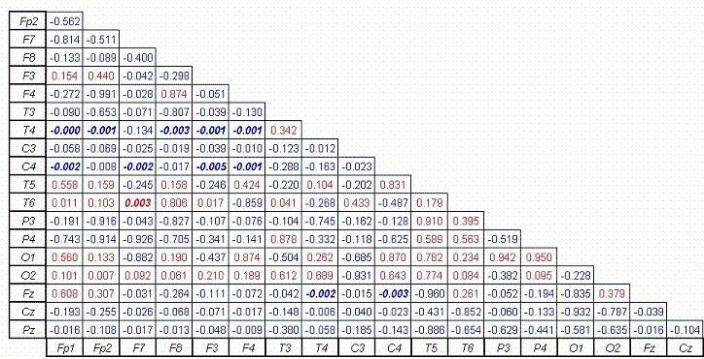
Figure 5. Comparer les résultats des changements dans alpha cohérence, avec un taux de Discovery False (FDR) de l'alpha p = 0,0053.
La figure 6 montre, les analyses de la bande bêta trouvant 43 paires d'électrodes avec une diminution significative de la connectivité neuronale.

Figure 6. Compare les résultats des changements de bêta cohérence, avec un taux de Discovery False (FDR) de l'alpha p = 0,064.
Comme on le voit sur la figure 7, les analyses portant sur la connectivité totale ont révélé 42 sites de neurones avec des réductions significatives de la connectivité. La connectivité totale est une analyse de la connectivité qui englobe l'ensemble du spectre EEG (0,5 à 22 Hz).
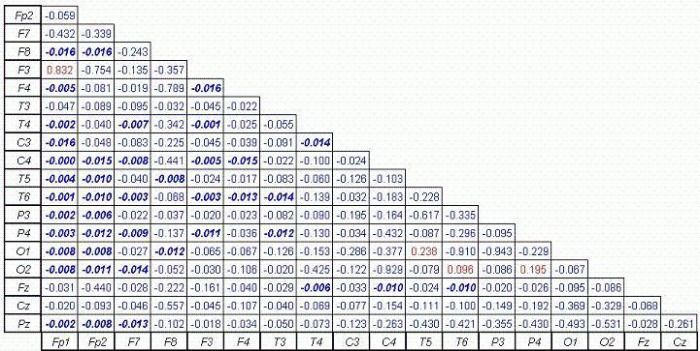
Figure 7. Compare les résultats des changements dans la cohérence totale, avec un taux de Discovery False (FDR) de l'alpha p <= 0,0164.
La figure 8 présente une représentation graphique de nos calculs de comparaison. Les lignes bleues entre les points focaux ont indiqué un ralentissement dans la connectivité, tandis que les lignes orange indiquent une augmentation de la connectivité. En outre, seuls les résultats significatifs sont présentés. Comme le montre notre analyse, la connectivité traite et guidée par Neurofeedback (biofeedback EEG) produit principalement des réductions de la connectivité neuronale. En outre, ces baisses de connectivité semblaient se produire principalement dans la région fronto-temporale, en particulier sur le côté droit.
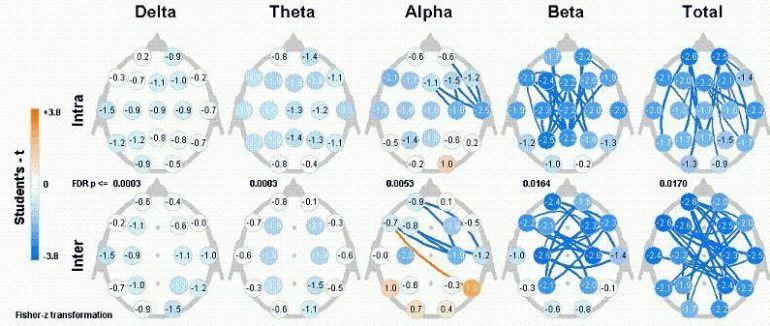
Figure 8. Représentation graphique de comparer les résultats illustrant les changements focaux dans la connectivité neuronale.
L’analyse sLORETA a également été calculée pour le groupe de contrôle en conditions pré à post-traitement.
Analogue au groupe expérimental, pour comparer l'amplitude de la densité de courant dans les deux conditions du contrôle des listes d'attente (pré-post), nous avons utilisé la randomisation-permutation comparaison multiple t-max approche (Congedo et al.,2004). Les approches de données de permutation on peut s’adapter a la structure de corrélation des variables, intégrant toutes les mesures électrophysiologiques (Holmes et al., 1996). Encore une fois, nous avons effectué un test pour chacune des régions passe-bande 13 fréquence (delta, thêta, alpha, bêta, basse fréquence, haute fréquence, alpha1, alpha2, beta1, beta2, beta3, beta4 et beta5). Dans les tests t ont été calculés l'ensemble de données (2,394 x 9 variables), voxel par voxel. Ceci est le test t pour les dessins appariés. Dans cet essai, la moyenne des deux conditions suivantes est comparée. Un seuil de signification (si l'hypothèse nulle était globale faux) a ensuite été calculée par la méthode de T-max. Pour toutes les bandes, nous avons testé l'hypothèse selon laquelle l'amplitude moyenne LORETA de densité de courant des deux conditions diffèrent en soustrayant les valeurs de la condition préalable de la post-condition (Congedo et al., 2004). En outre, les résultats ont révélé qu'il n'y avait aucun changement significatif de pré à post-conditions parmi les participants du groupe de contrôle des listes d'attente en utilisant un niveau de p <10 alpha.
Les analyses statistiques effectuées sur le groupe expérimental ont également été mises en œuvre pour les 12 participants du groupe témoin afin de tester des changements importants dans la cohérence. L'analyse a révélé que de pré à post-conditions, le groupe de contrôle n’a eu aucun changement significatif dans la cohérence. Comme pour l'analyse de groupe expérimental, l'inclusion de FDR (Benjamini & Hochberg, 1995) protège cette analyse d'erreurs associées à des comparaisons multiples. En outre, l'analyse a montré que dans le groupe témoin aucun emplacement de l'électrode a approché un p <10 niveau.
Discussion :
La principale conclusion de cette étude est la preuve que la connectivité guidée par Neurofeedback (biofeedback EEG) est un traitement capable de provoquer des changements neurophysiologiques thérapeutiques dans le cerveau des enfants atteints de TSA.
Des réductions significatives de la cohérence entre les nombreuses régions neurales se sont produites à la suite de cette intervention. Ces résultats ont ensuite été confirmés par l'analyse eLORETA, qui a montré à la source, des changements importants localisés de potentialités dans les régions cruciales du cerveau de ces enfants.
Ces changements étaient évidents à travers le frontal, le temporal, et les régions limbiques. Les résultats de l'étude soutiennent et ont également élargi les résultats trouvés précédemment (Coben & Padolsky, 2007).
Dans notre étude précédente, nous avons atteint un taux de réussite de 89% (suite au traitement) taux qui a été couplé avec une réduction de 40% dans les principaux symptômes de TSA.
En outre, des améliorations significatives ont été notées pour le groupe expérimental sur les mesures de l'attention, l'exécutif, la perception visuelle, et les fonctions linguistiques.
En revanche, notre analyse a révélé que le groupe de contrôle ne diffère pas significativement du groupe expérimental à la fin de notre étude précédente de sorte que 83% des parents de ce groupe n’ont rapporté aucun changement.
Les résultats cliniques significatifs rapportés précédemment sont maintenant renforcés par les changements de neurophysiologie actuels. Cela fournit désormais des preuves préliminaires que la connectivité traitée et guidée par Neurofeedback (biofeedback EEG) est capable de produire des changements neurophysiologiques tout en réduisant simultanément les symptômes autistiques.
Plus précisément, les résultats trouvés précédemment, couplés avec nos résultats, fournissent des preuves qui lient des réductions de hypercoherence et de la puissance de la source localisée, à des réductions des symptômes autistiques.
Cela a une double importance :
Premièrement, notre analyse a montré que la résultante diminution en hypercoherence dérivée de la connectivité traitée et guidée par Neurofeedback (biofeedback EEG) semblait se regrouper autour de la région fronto-temporale. Ce sont les régions ciblées pour le traitement. Cela donne à penser que le traitement par Neurofeedback sur des régions spécifiques, peut avoir des effets spécifiques localisés. Deuxièmement, cette constatation apporte un soutien à la théorie de l'implication du système frontal ASD indiqué par les enquêtes précédentes (Courchesne & Pierce, 2005;. Buxhoeveden et al., 2004; Rippon et al, 2007).
La théorie de l’hypercoherence / connectivité, en ce qui concerne les symptômes autistiques, a fait l'objet de plusieurs enquêtes. Courchesne et Pierce (2005) ont rapporté des de plus de connectivité dans les lobes frontaux, ainsi que des modèles de sous-connectivité entre le lobe frontal et d'autres régions du cerveau. Courchesne, Redkay et Kennedy (2004) ont précédemment attribué ces résultats à une augmentation anormale dans les neurones de la matière grise et blanche du frontal et le lobe temporal qui se produisent entre les âges de 2 à 4 ans. Ces augmentations anormales de la matière cérébrale ou neuroinflammation du développement précoce sont pensés pour provoquer des dysfonctionnements dans le cerveau, en particulier dans le frontal minicolonne microcircuits (Courchesne & Pierce, 2005). La Neuroinflammation est également pensée pour expliquer la découverte des tailles de tête agrandies trouvés chez les enfants atteints de TSA (Herbert et al., 2003; Herbert et al., 2004). On suppose que sur la connectivité peut résulter cette neuroinflammation, en raison de la tendance des neurones qui sont excités de communiquer plus facilement avec d'autres neurones qui sont à proximité (Courchesne & Pierce, 2005).
En outre, comme les régions neurales sont élargies, l'espace de neuropile est réduite, ce qui provoque une augmentation de neurones à proximité qui à son tour augmente l’hyperconnectivité (Buxhoeveden et al., 2004). De même, la sous-connectivité du cortex frontal à d'autres régions neurales est produite en raison de l'incapacité du cerveau hyperconnecté à former des communications suffisantes avec d'autres domaines. Conformément à cela, les résultats récents ont indiqué que la neuroinflammation de la matière blanche entrave la capacité du cerveau autiste, à se connecter ou à intégrer des informations provenant d'autres parties du cerveau (Herbert, 2005). Cette incapacité à communiquer efficacement entre les assemblées de neurones peut entraîner des déficits dans les domaines qui nécessitent plus de coordination et de communication entre les zones du cerveau, à savoir la langue et le fonctionnement exécutif. En outre, ce phénomène peut facilement être décrit comme trop de services locaux concurrents en eux-mêmes, et à son tour, une diminution de la qualité de communication longue distance.
Ces anomalies neurales de hyper- et hypoconnectivity dans l'autisme ont également été décrites comme étant la conséquence d'un système d'élagage défectueux. Frith (2003) a émis l'hypothèse que les déficits cérébraux neurophysiologiques associés à l'autisme sont le résultat d'un système d'élagage neuronal qui ne parvient pas à éliminer les connexions défectueuses clés, au cours des stades de développement. Ce système d'élagage joue un rôle important dans la coordination du fonctionnement de neurones chez les individus en bonne santé. L'échec de ces connexions inutiles, interfère avec des connexions neuronales normales tant au niveau local et longue distance qu’au sein du cerveau.
Lorsque les connexions neuronales frontales de longue distance sont perturbées, apparaissent alors les déficits résultant de l'intégration des informations provenant du terrain émotionnel, sensoriel, de la langue avec la production des systèmes automatiques (Pierce & Courchesne, 2005). En outre, la perturbation de faisceaux de matière blanche, comme décrite précédemment, peut entraîner un déficit de la cognition sociale, associée à des zones de neurones responsables de la reconnaissance des visages, du traitement du regard, de la conscience des états mentaux, et du traitement des émotions (Barnea-Goraly et al., 2004). En outre, les déficits des réseaux corticaux frontaux peuvent conduire à des déficiences de fonctionnement de direction dans les domaines du comportement personnel et social, de l'émotion et de la prise de décision (Salloway et al, 2001;. & Courchesne Pierce, 2005). De même, les déficits dans la zone corticale du système limbique, notamment la partie antérieure du gyrus cingulaire, sont théorisés pour entraîner des carences dans le traitement des émotions, le contrôle des expressions faciales, et les dimensions affectives de la douleur (Williams et al., 2005). L’insuffisance dans le lobe temporal, en particulier l'amygdale, a été mis en corrélation avec l'affaiblissement autiste lié au fonctionnement social et comportemental (Baron-Cohen et al., 2000). Enfin, en réduisant thérapeutiquement (Neurofeedback) la hypercoherence dans ces zones neuronales, comme cela a été réalisé dans cette étude, on pense que les déficits et physiopathologies mentionnés précédemment peuvent être réduits et que les changements de comportement positifs peuvent être obtenus.
Notre étude contribue à la recherche mentionnée ci-dessus en présentant des preuves qui montre que la réduction de l’hypercoherence peut jouer un rôle essentiel dans les résultats des traitements améliorés qui résultent de la connectivité traitée et guidée par Neurofeedback (biofeedback EEG). Les preuves présentées de réductions de liaison dans l’hypercoherence frontotemporale, comme un moyen de produire des gains thérapeutiques dans l’autisme, est une nouvelle confirmation des rôles essentiels de ces régions du cerveau jouant dans les symptômes de troubles autistiques.
Cette étude est la première à présenter des preuves qu’un traitement (Neurofeedback) des TSA est capable de changer thérapeutiquement le dysfonctionnement neurophysiologique qui est au cœur des symptômes autistiques. Les baisses de cohérence neuronale qui ont été obtenues dans la présente étude inclut le frontal, temporal, et les structures limbiques sous-jacentes. Comme indiqué précédemment, ces zones ont été confirmées pour être associées à une déficience autiste (Salloway et al, 2001;. & Courchesne Pierce, 2005;. Williams et al., 2005; Baron-Cohen et al, 2000). En tant que tel, les gains positifs obtenus par un impact thérapeutique du Neurofeedback dans ces zones neuronales confirment leur implication dans les TSA, et fournit également un aperçu des mécanismes neurophysiologiques généraux responsables de l'efficacité de cette thérapie.
Les changements neurophysiologiques importants examinés peuvent être attribués au traitement par Neurofeedback, avec peu de risque d'erreur dû à la mise en œuvre des indices FDR (benjamini & Hochberg, 1995) et la randomisation-multiple permutation analyses (Congedo et al., 2004).
De plus, ces changements sont des évolutions d’amélioration, en raison des progressions quant aux gains cognitifs et à la réduction des symptômes autistes- avec l'achèvement de 20 sessions de connectivité, résultats thérapeutiques très positifs pour les sujets, après le traitement fait par Neurofeedback (biofeedback EEG). Ces résultats sont encore renforcés par notre analyse, qui a révélé que le groupe témoin liste d'attente n'a signalé aucun changement significatif de pré à post-conditions.
Notre analyse a montré qu'il y avait des changements positifs dans le pouvoir absolu localisé (eLORETA) des bandes à fréquences inférieures; tandis que les résultats indiquent également que les changements de la cohérence ont été observés de manière prédominante dans les hautes fréquences de la bande alpha et bêta. La raison de cet écart n’a pas encore été clairement comprise. En outre, il faudrait de plus en plus d’études pour comprendre pleinement les implications de cette différence.
Récemment, Pineda et al. (2007) ont étudié les changements de comportement à la suite du traitement avec le Neurofeedback chez les enfants atteints d'autisme. Les résultats ont montré des effets positifs : dans les changements de comportement en dans le discours / langue, Sociabilité et santé / physiques sous-échelles de comportement de l'ATEC, ainsi que le score total. Cependant, lorsque l'on compare ces données à celles de notre étude (liée à la cohérence), nos résultats révèlent d’un taux d’efficacité d’environ trois fois supérieur. De plus, notre étude ne voit aucune dégradation ou aggravation des symptômes tels qu'évalués par des sous-échelles de l'ATEC. A l'inverse, Pineda et al. (2007) ont présenté des preuves de changements négatifs dans le comportement en termes de Sensory / Cognitive sensibilisation sous-échelle de l'ATEC
Poursuivant, l’étude de Pineda et al. (2007), a choisi de montrer le rythme Mu principalement sur l'hémisphère droit du cerveau en se concentrant sur l'électrode place C4 ainsi que des domaines choisis en fonction de l'activité EMG. Cette technique a produit une diminution significative de la cohérence pour une seule paire de neurones (C3-C4; Etude 1) et trois paires de neurones (T3 -T4; C3-C4; F3-F4) pour l'étude de deux (. Pineda et al, 2007).
D’autre part, dans notre étude, sur la base d’une thérapie avec l'analyse EEGQ de chaque individu, qui a révélé des domaines spécifiques de hypercoherence maximale, nous postulons que ces mesures nous ont servi comme une raison sous-jacente, pour nous permettre de réduire de manière significative la cohérence entre la mesure de paires neuronales (Voir à la Fig. 5 à 7).
Le succès de notre étude, utilisant l’analyse personnalisé QEEG (EEGQ) avant le traitement, a une réussite encore plus accru, par l'absence d'effets négatifs, en plus de nous avoir permis de planifier et de mener à bien le traitement par Neurofeedback, ce qui a aussi favorisé un travail de précision plus important.
De même, Coben et Myers (2008) ont récemment comparé les résultats des traitements par Neurofeedback (biofeedback EEG) basés sur l’analyse QEEG (EEGQ) , aux traitements Neurofeedback (biofeedback EEG) basés plutôt sur les symptômes (2002) enquête Jarusiewicz. Les résultats de cette analyse indiquent que la connectivité basée sur l’analyse QEEG (EEGQ) et traitée par Neurofeedback (biofeedback EEG) réalisait, en moyenne, un écart-type complet et une plus grande amélioration par rapport au traitement par Neurofeedback fondé sur les symptômes, tout en évitant les effets indésirables. L'implication des comparaisons de recherches mentionnées ci-dessus suggère que la personnalisation des protocoles EEG chez des sujets joue un rôle positif dans l'efficacité de notre traitement.
D'autres études récentes ont émis l'hypothèse que les effets positifs de Neurofeedback pour les personnes atteintes d'autisme pourraient être dus à des facteurs non spécifiques (Heinrich, Gevensleben, & Strehl, 2007; Kouijzer, van Schie, Gerrits, Buitelaar, & de Moor, 2013). Par exemple, Kouijzer et al. (2013) ont montré aucune différence d'effet entre le traitement par Neurofeedback (biofeedback EEG) et la conductance de la peau par biofeedback, mais les deux traitements procuraient la réduction des symptômes autistes par rapport à un groupe témoin sans-traitement. Ils ont alors conclu, que les effets bénéfiques pourraient être dus à « l'espérance du traitement », la sollicitation de formation implicite de l'attention et / ou à forte intensité de contact one-to-one avec un thérapeute. Cependant, ce traitement, ne comportait pas un traitement de la connectivité et de la cohérence.
Les résultats actuels de notre étude, indiquent des améliorations dans le fonctionnement clinique associées à des changements neurophysiologiques liés au traitement par Neurofeedback, ce fonctionnement que le cerveau ne produit pas (comparaison avec le groupe « liste d'attente »). Cela indique une forte probabilité qu'il y ait des effets spécifiques dus au traitement par Neurofeedback, mécanismes de cohérence altérés, corrigés par l'action du traitement sous la direction du thérapeute.
Fait intéressant qui met en lumière l’importance du profil du soignant-thérapeute : son implication dans le traitement, son bagage et son expérience, pour les résultats du traitement. Choix primordial du traitement qui a amené le suivi à avoir des impacts différents.
En ce qui concerne les limites de notre étude, les participants se composaient d'un pool sélectionné de sujets. Afin d’éviter d’interagir avec les effets du traitement - lorsque les parents des sujets, ou les sujets eux-mêmes choisissent leur traitement préféré, il existe un risque biaisé de sélection qui peut interagir avec l'effet du traitement. Ainsi, l’attribution pour appartenir aux groupes expérimentaux et aux groupes de contrôle, a été faite de manière aléatoire afin de tester les interactions entre l'effet du traitement et de la sélection des sujets.
Nos conclusions sur ces preuves et témoignages, en tant qu'expert en neurofeedback :
Recommandations :
Des efforts pourraient être faits pour inclure plus de sujets ayant une sévérité accrue des symptômes, ainsi que pour plus d'homogénéité en termes d'âge. Cela permettrait de mieux évaluer si la gravité des symptômes autistiques modère l'efficacité du traitement. En outre, pour mesurer plus précisément les effets de notre traitement, une conception en double aveugle serait à recommander, dans laquelle l'affectation des sujets serait inconnue tant par les sujets que par les expérimentateurs.
En outre, l'ajout d'un autre traitement (en dehors du Neurofeedback) pour le groupe de comparaison contrôlé par placebo, pourrait aider à mieux évaluer l'efficacité de la connectivité traitée par Neurofeedback (biofeedback EEG) et pourrait aider à démontrer, que nos résultats ne sont pas attribuables au hasard d’une variable non contrôlée. Des futures évaluations périodiques du suivi seraient également bénéfiques pour déterminer l'efficacité de notre intervention sur une longue période de temps. Cela permettrait de mieux démontrer l'efficacité continue au fil du temps, de la connectivité traité par Neurofeedback (biofeedback EEG).
Nous recommandons également pour des futures études, d’analyser plus précisément la relation entre la connectivité / cohérence et l'autisme. La présente étude a fourni des preuves reliant ces deux concepts les uns aux autres et aux déficiences autistes; toutefois, des recherches supplémentaires devraient être menées afin de valider durablement cette affirmation.
Enfin, l'ajout de techniques alternatives d'imagerie (à savoir, IRM ou DTI), utilisées en tandem avec l'analyse QEEG, permettrait de mieux valider les changements neurophysiologiques trouvés actuellement.
References :
Etude publiéNeuroRegulation Vol. 1(2):109-130 2014 doi:10.15540/nr.1.2.109 http://www.neuroregulation.org
American Psychiatric Association. (1994). Diagnostic and statistical manual of mental disorders (4th ed.). Washington, DC: Author.
Baron-Cohen, S. (2004). The cognitive neuroscience of autism. Journal of Neurology, Neurosurgery & Psychiatry, 75, 945-948. http://dx.doi.org/10.1136/jnnp.2003.018713
Baron-Cohen, S., Ring, H. A., Bullmore, E. T., Wheelwright, S., Ashwin, C., & Williams, S. C. (2000). The amygdale theory of autism. Neuroscience and Biobehavioural Reviews, 24, 355-364. http://dx.doi.org/10.1016/S0149-7634(00)00011-7
Barnea-Goraly, N., Kwon, H., Menon, V., Eliez, S., Lotspeich, L., & Reiss, A.L. (2004). White matter structure in autism: Preliminary evidence from diffusion tensor imaging. Biological Psychiatry, 55, 323-326. http://dx.doi.org/10.1016/j.biopsych.2003.10.022
Belmonte, M. K., Allen, G., Beckel-Mitchener, A., Boulanger, L. M., Carper, R. A., & Webb, S. J. (2004). Autism and abnormal development of brain connectivity. The Journal of Neuroscience, 24(42), 9228-9231. http://dx.doi.org/10.1523/JNEUROSCI.3340-04.2004
Benjamini, Y. & Hochberg, Y. (1995). Controlling the false discovery date: A practical and powerful approach to multiple testing. Journal of the Royal Statistical Society, 57, 289-300
Bendat, J. S. & Piersol, A. G. (1980). Engineering applications of correlation and spectral analysis. New York: John Wiley and Sons.
Brodmann, K. (2005). Brodmann's: Localisation in the cerebral cortex. (L.J. Garey, Trans.). New York: Springer. (Original work published 1909).
Buxhoeveden, D., Semendeferi, K., Schenker, N., & Courchesne, E. (2004). Decreased cell column spacing in autism. Social Neuroscience, 582, 6.
Cantor, D. S., Thatcher, R. W., Hrybyk, M., & Kaye, H. (1986). Computerized EEG analyses of Autistic children. Journal of Autism and Developmental Disorders, 16, 169–187.
Center for Disease Control and Prevention (2014). Prevalence of Autism Spectrum Disorder Among Children Aged 8 Years — Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2010. Morbidity and Mortality Weekly Report, 63(SS02), 1–21. http://www.cdc.gov/mmwr/preview/mmwrhtml/ss6302a1.htm?s_cid=ss6302a1_w
Coben, R. (2007). Connectivity-guided neurofeedback for autistic spectrum disorder. Biofeedback, 35(4), 131-135.
Coben, R., Chabot, R. J., & Hirschberg, L. (2013). EEG analyses in the assessment of autistic disorders. In Cassanova, M. F., Ayman, S. E., Suri, J. (Eds.), Imaging the Brain in Autism (349-369). Springer Science + Business Media New York.
Coben, R. Clarke, A. R., Hudspeth, W., & Barry, R. J. (2008). EEG power and coherence in autistic spectrum disorder. Clinical Neurophysiology, 119, 1002 http://dx.doi.org/10.1016/j.clinph.2008.01.013
Coben, R., & Myers, T. E. (2008). Connectivity theory of autism: Use of connectivity measures in assessing and treating autistic disorders. Journal of Neurotherapy,12, 161-179. http://dx.doi.org/10.1080/10874200802398824
Coben, R., & Padolsky, I. (2007). Assessment-guided neurofeedback for autistic spectrum disorder. Journal of Neurotherapy, 11, 5-23. http://dx.doi.org/10.1300/J184v11n01_02
Collins D. L., Neelin P., Peters T. M., & Evans A. C. (1994). Automatic 3D intersubject registration of MR volumetric data in standardized Talairach space. Journal of Computer Assisted Tomography, 18, 192-205.
Congedo, M., Finos, L., & Turkheimer, F. (2004). A multiple hypothesis test procedure based on the sum of test-statistics, 10th Annual Meeting of the Organization for Human Brain Mapping, June 13-17, Budapest, Hungary. (Abstract) on CD.
Courchesne, E., Recay, E., & Kennedy, D. P. (2004). The autistic brain: Birth through adulthood. Current Opinion in Neurology, 17(4), 489-496. http://dx.doi.org/10.1097/01.wco.0000137542.14610.b4
Courchesne, E., & Pierce, K. (2005). Why the frontal cortex in autism might be talking only to itself: Local over-connectivity but long-distance disconnection. Current Opinion in Neurobiology, 15, 225–230. http://dx.doi.org/10.1016/j.conb.2005.03.001
Deymed Diagnostic (2004). TruScan 32 Specifications. Retrieved June 16, 2008 from http://www.deymed.com/truscan32.asp
Egner, T. & Sterman, M. B. (2006). Neurofeedback treatment of epilepsy: From basic rationale to practical application. Expert Review of Neurotherapeutics, 6(2), 247-257. http://dx.doi.org/10.1586/14737175.6.2.247
Evans, J. R., & Park, N. S. (1996). Quantitative EEG abnormalities in a sample of dyslexic persons. Journal of Neurotherapy, 2(1), 1-5.
Frei, E., Gamma, A., Pascual-Marqui, R. D., Lehmann, D., Hell, D., & Vollenwider, F. X. (2001). Localization of MDMA-induced brain activity in healthy volunteers using low resolution brain electromagnetic tomography (LORETA). Human Brain Mapping, 14, 152-165. http://dx.doi.org/10.1002/hbm.1049
Filipek, P. A., Accardo, P. J., Ashwal, S., Baranek, G. T., Cook, E. H., Dawson, G., …, Volkmar, F. R. (1999). Practice parameter: Screening and diagnosis of autism. Journal of Autism and Developmental Disorders, 29(6), 439-484.
Frith, C. D. (2003) What do imaging studies tell us about the neural basis of autism? In Autism: neural basis and treatment possibilities (ed. M. Rutter), Novartis Foundation. Chichester, UK: Wiley.
Ganz, M. (2006). The costs of autism. In Moldin, S. & Rubenstein, J. L. (Ed.), Understanding autism: from basic neuroscience to treatment (pp. 476-498). New York, NY: CRC Press.
Gilliam, J. E. (1995). Gilliam Autism Rating Scale Examiner’s Manual. Austin, Texas: Pro-Ed.
Gilliam, J. E. (2001). Gilliam Asperger’s Disorder Scale Examiner’s Manual. Austin, Texas: Pro-Ed.
Gioia, G. A., Isquith, P. K., Guy, S. C., & Kenworthy, L. (2000). Behavior Rating Inventory of Executive Function. Lutz, FL:.Psychological Assessment Resources, Inc.
Grass SafeLead (2006). Genuine grass precious metal recording electrodes: SafeLead. Retrieved June 17, 2008 from http://www.grasstechnologies.com/
Hammond, D. C. (2007). What is neurofeedback? Journal of Neurotherapy, 10(4), 25-36. http://dx.doi.org/10.1300/J184v10n04_04
Heinrich, H, Gevensleben, H. & Strehl, U. (2007). Annotation: Neurofeedback – train your brain to train behavior. Journal of Clinical Psychology and Psychiatry, 48(1), 3-16. http://dx.doi.org/10.1111/j.1469-7610.2006.01665.x
Herbert, M.R., Ziegler, D.A., Makris, N., Bakardjiev, A., Hodgson, J., Adrien, K.T.,,… Caviness, V.S. (2003). Larger brain and white matter volumes in children with developmental language disorder. Developmental Science, 6(4), F11-F22. http://dx.doi.org/10.1111/1467-7687.00291
Herbert, M. R., Ziegler, D. A., Makris, N., Filipek, P. A., Kemper, T. L., Normandin, J. J., … Caviness, V. S. (2004). Localization of white matter volume increase in autism and developmental language disorder. Annals of Neurology, 55, 530-540. http://dx.doi.org/10.1002/ana.20032
Herbert, M.R. (2005). Large brains in autism: The challenge of pervasive abnormality The Neuroscientist, 11(5), 417–440. http://dx.doi.org/10.1177/0091270005278866
Holmes, A. P., Blair, R. C., Watson, J. D. G., & Ford, I. (1996). Nonparametric analysis of statistic images from functional mapping experiments. Journal of Cerebral Blood Flow & Metabolism, 16, 7-22.
Hudspeth, W. J. (1999). NeuroRep QEEG analysis and report software (Version 4.0) [Computer Software]. Los Osos, CA: Grey Matter Inc.
Jarusiewicz, B. (2002). Efficacy of neurofeedback for children in the autistic spectrum. A pilot study. Journal of Neurotherapy, 6(4), 39-49. http://dx.doi.org/10.1300/J184v06n04_05
John, E. R., Prichep, L. S, & Easton, P. (1987). Normative data banks and neurometrics: Basic concepts, method and results of norm constructions in method of analysis of brain electrical and magnetic signals. In: Gevins, A. S. & Remond A., (Ed.)., EEG Handbook (revised series. Vol.1), New York: Elsevier Science Publishers.
John, E. R., Prichep, L., Fridman, J., & Easton, P. (1988). Neurometrics: Computer-assisted differential diagnosis of brain dysfunction. Science, 239, 162-169.
Koechlin, E. & Hyafil, A. (2007). Anterior prefrontal function and the limits of human decision-making. Science, 311, 594-598. http://dx.doi.org/10.1126/science.1142995
Kouijzer, M. E., van Schie, H. T., Gerrits, B. J. L., Buitelaar, J. K., & de Moor, J. M. H. (2013). Is EEG-Biofeedback an effective treatment in autism spectrum disorders? A randomized controlled trial. Appl Psychophysiol Biofeedback, 38, 17–28. http://dx.doi.org/:10.1007/s10484-012-9204-3
Lachar, D., & Gruber, C. P. (2001). The personality inventory for children, second edition. Los Angeles, CA: Western Psychological Services.
Leins, U., Goth, G., Hinterberger, T., Klinger, C., Rumpf, N., & Strehl, U. (2007). Neurofeedback for children with ADHD: A comparison of SCP and Theta/Beta protocols. Applied Psychophysiology and Biofeedback, 32, 73-88. http://dx.doi.org/10.1007/s10484-007-9031-0
Lubar, J. F., Swartwood, M. O., Swartwood, J. N., & O’Donnell, P. H. (2005). Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Applied Psychophysiology and Biofeedback, 20, 83-99. http://dx.doi.org/10.1007/BF01712768
Lubar, J. F., Congedo M., & Askew, J. H. (2003). Low-resolution electromagnetic tomography (loreta) of cerebral activity in chronic depressive disorder. International Journal of Psychophysiology, 49, 175-185. http://dx.doi.org/10.1016/S0167-8760(03)00115-6
Miller, C.J., Genovese, C., Nichol, R.C., Wasserman, L., Connolly, A., Reichart, D., Hopkins, A., Schneider, J. & Moore, A. (2001). Controlling the false discovery rate in astrophysical data analysis. The Astronomical Journal, 122, 3492-3505.
Mizuno, A., Villalobos, M. E., Davies, M. M., Dahl, B. C., & Muller, R. A. (2006). Partially enhanced thalamocortical functional connectivity in autism. Brain Research, 1104, 160–174. http://dx.doi.org/10.1016/j.brainres.2006.05.064
Monastra, V. J., Monastra, D. M., & George, S. (2002). The effects of stimulant therapy, EEG biofeedback, and parenting style on the primary symptoms of attention-deficit/hyperactivity disorder. Applied Psychophysiology and Biofeedback, 27, 231-249.
Murias, M., Webb, S. J., Greenson, J., & Dawson, G. (2007). Resting state cortical connectivity reflected in EEG coherence in individuals with autism. Biological Psychiatry, 62, 270–273. http://dx.doi.org/10.1016/j.biopsych.2006.11.012
NeuroCybernetics Inc. (2006). Specific EEGer technical parameters. Canoga Park, CA: NeuroCybernetics, Inc. NxLink (2001). Neurometric analysis system. Richland, WA: Nxlink Ltd.
Pascual-Marqui, R. D. (1999). Review of methods for solving the EEG inverse problem. International Journal of Bioelectromagnetism, 1(1), 75-86.
Pascual-Marqui, R. D. (2007). Discrete, 3D distributed linear imaging methods of electric neuronal activity. Part I: exact, zero localization. Retrieved October 16, 2008 from http://www.uzh.ch/keyinst/eLORETA/eLor0errLikeItOrNot.pdf
Pascual-Marqui, R. D., Esslen, M., Kochi, K., & Lehmann, D. (2002). Functional imaging with low resolution brain electromagnetic tomography (LORETA): A review. Methods & Findings in Experimental & Clinical Pharmacology, 24C, 91-95.
Pascual-Marqui, R. D., Michel, C. M., & Lehmann, D. (1994). Low resolution electromagnetic tomography: A new method for localizing electrical activity in the brain. International Journal of Psychophysiology,18, 49-65.1.
Rimland, B., & Edelson, S. M. (2000). Autism treatment evolution checklist (ATEC). Retrieved October 13, 2008 from https://www.autismeval.com/ari-atec/report1.html
Rippon, G., Brock, J., Brown, C., & Boucher, J. (2007). Disordered connectivity in the autistic brain: Challenges for the new psychophysiology‖. International Journal of Psychophysiology, 63, 164–172. http://dx.doi.org/10.1016/j.ijpsycho.2006.03.012
Safran, S.P. (2008). Why youngsters with autistic spectrum disorders remain underrepresented in special education. Remedial and Special Education, 29(2), 90-95. http://dx.doi.org/10.1177/0741932507311637
Salloway, S. P., Malloy, P. F., & Duffy, J. D. (2001). The frontal lobes and neuropsychiatric illness. Washington D.C.: American Psychiatric Publishing, Inc.
Sherlin, L., Budzynski, T., Budzynski, H. K., Congedo, M., Fischer, M. E., & Buchwalk, D. (2007). Low-resolution electromagnetic brain tomography (LORETA) of monozygotic twins discordant for chronic fatigue syndrome. NeuroImage, 34(4), 1438-1442. http://dx.doi.org/10.1016/j.neuroimage.2006.11.007
Talairach J, & Tournoux, P. (1988). Co-planar stereotaxic atlas of the human brain: Three-dimensional proportional system. Georg Thieme: Stuttgart.
Thatcher, R. W., Walker, R. A., Biver, C. J., North, D. N., & Curtin, R. (2003). Quantitative EEG normative databases: Validation and clinical correlation. In Lubar, J. F. (Ed.) Quantitative electroencephalographic analysis (QEEG) databases for neurotherapy: Descriptions, validation, and applications (pp.87-121). New York: Haworth Press.
Thatcher, R. W., Krause, J. & Hrybyk (1986). Cortico-cortical associations and EEG coherence: a two-comportmental model. Electroencephalography and Clinical Neurophysiology, 64, 123-143.
Towle, V. L., Bolaños, J., Suarez, D., Tan, K., Grzeszczuk, R., Levin, D. N., Cakmur, R., Frank, S. A., & Spire, J. (1993). The spatial location of EEG electrodes: Locating the best fitting sphere relative to cortical anatomy. Electroencephalography and Clinical Neuroscience, 86:1-6.
Walker, J. E., Kozlowski, G. P., & Lawson, R. (2007). A modular activation/coherence approach to evaluating clinical/QEEG correlations and for guiding neurofeedback training: Modular insufficiencies, modular excesses, disconnections, and hyperconnections. Journal of Neurotherapy, 11, 25-44. http://dx.doi.org/10.1300/J184v11n01_03
Williams, S. M., White, L. E., & Mace, A. C. (2005). SylviusVG: Visual glossary of human neuroanatomy. Sunderland, MA: Puramis Studios, Inc.
Yeargin-Allsopp, M., Rice, C., Karapurkar, T., Doernberg, N., Boyle, C. & Murphy, C. (2003). Prevalence of autism in a US metropolitan area. Journal of American Medical Association, 289(1), 49-55. http://dx.doi.org/10.1001/jama.289.1.49
Ruby Villar-Documet




