NEUROSCIENCES CLINIQUES APPLIQUEES, PARIS COURBEVOIE
AVEC UNE PSYCHOLOGUE CLINICIENNE
Le cerveau : « La Connectivité »
La thérapie par les neurosciences est personnalisée et appliquée selon les profils et les besoins de soins.
Je suis Ruby Villar-Documet, Psychologue clinicienne d'orientation scientifique et psychothérapeute, j’exerce en consultation privée à Courbevoie près de Paris. Mon atout pour l’exercice, est une combinaison d'expertise scientifique et d’expérience clinique de plus de 25 ans.
Mon éventail d’expériences professionnelles dans des contextes qualifiés :
- Hospitalier spécialisé (troubles psychiatriques).
- Expertise psychologique (criminologie – troubles psychiques).
- Enseignement universitaire (psychopathologies).
- Clinique et Recherche Cognitive spécialisée (cerveau humain, troubles psychiques, troubles neurodéveloppementaux et PsychoNeurothérapies en rapport : : phobie, émétophobie, autisme Asperger, TSA, hyperactivité ou TDAH, rééducation du cerveau...).
Mon approche thérapeutique en tant que psychologue clinicienne :
Ma pratique se veut : humaine, déontologique, évolutive, efficace et avant-gardiste. Ma palette de solutions thérapeutique intègre : l’Hypnose, la Thérapie Psychique, la Thérapie Cognitive Comportementale (TCC), la Thérapie Psychanalytique, la Thérapie Psycho-corporelle … ainsi qu’une approche dynamique, des Neurosciences Cliniques « La Neurothérapie par Neurofeedback Scientifique (QEEG) ».
La connectivité du cerveau
Publication apparue sous le titre :
« Place de l'anatomie dans la cartographie fonctionnelle du cerveau »
J.-F. Mangin1, J. Régis2, J.-B. Poline1, D. Rivière1, C. Poupon1,6, F. Poupon1, D. Papadopoulos1, F. Delaye1,3, O. Pizzato1,3, O. Coulon1,6, S. Crozier1,4, P. Belin1, P. Remy1, M. Zilbovicius1, C. Clark1, D. Lebihan1, D. Hasboun5, S. Lehericy5, D. Dormont5, O. de Dreuille3, H. Foehrenbach3, J.-F. Gaillard3, I. Bloch6, Y. Samson1,4, V. Frouin1
1 : Service Hospitalier Frédéric Joliot, Département de Recherche Médicale, DSV, CEA, Orsay E-mail : mangin@shfj.cea.fr,
2 : Service de Neurochirurgie Fonctionnelle et Stéréotaxique, La Timone, Marseille
3 : Service de Médecine Nucléaire, Val-de-Grâce, Paris
4 : Service des Urgences Vasculaires, La Pitié-Salpétrière, Paris
5 : Service de Neuroradiologie, La Pitié-Salpétrière, Paris
6 : Département Signal et Image, Ecole Nationale Supérieure des Télécommunications, Paris
Résumé : L'essor des techniques d'imagerie fonctionnelle auquel nous assistons depuis une quinzaine d'années a profondément modifié la manière d'aborder la cartographie fonctionnelle du cerveau humain. Il a conduit à l'émergence de vastes projets confrontés à la manipulation d'énormes quantités de données anatomo-fonctionnelles. Ces projets impliquent la possibilité de comparer des individus et de thésauriser les résultats obtenus en matière de localisation anatomique par rapport à un référentiel. Dans cet article, nous décrivons les différentes démarches proposées à ce jour pour répondre à ces besoins et leurs évolutions prévisibles.
La cartographie du cerveau
L'anatomie du cerveau a souvent joué un rôle ambigu dans les innombrables travaux visant à dévoiler le fonctionnement de l'esprit humain. L'ambition de rapporter chaque faculté à l'activité d'une structure particulière du cerveau a d'abord donné lieu au cours de l'histoire à de nombreuses hypothèses fantaisistes qui ont culminé au début du 19è siècle avec la phrénologie de Gall [8, 28, 64]. Cette démarche « localisationiste » s'opposait alors à une thèse « globaliste » qui prônait une localisation diffuse des fonctions mentales. La thèse défendue par Gall d'un déterminisme biologique en ce qui concerne les capacités mentales ainsi que le caractère arbitraire de sa cartographie expliquent l'existence depuis cette époque d'une répugnance encore vivace aujourd'hui à établir des corrélations entre anatomie morphologique corticale et fonction.
Néanmoins, l'observation de malades atteints de lésions cérébrales focales (Broca [5]) et des stimulations électriques du cortex chez l'animal (Ferrier [ 18]) puis chez l'homme pendant certaines opérations neurochirurgicales (Penfield [53]) permirent d'établir les premières cartes fonctionnelles.
Les visions localisationistes et globalistes se sont alors peu à peu unifiées pour aboutir à une vision « connectiviste » du fonctionnement cérébral qui associe chaque processus cognitif à l'activité globale d'un réseau de modules localisés [77, 87].
En effet, la neuropsychologie classique s'est longtemps heurtée à la difficulté d'inférer des informations précises sur le fonctionnement du cerveau sain en étudiant les conséquences comportementales de lésions relativement mal définies. Il s'agissait pourtant autrefois d'une des rares manières d'étudier les fonctions propres à l'homme avec la mesure des temps de réaction et les premiers électroencéphalogrammes. En effet, les techniques d'observation invasives utilisées chez l'animal ne sont transposables à l'homme que dans des contextes neurochirurgicaux exceptionnels.
Expériences prouvant la cartographie du cerveau
Aujourd'hui, la possibilité de réaliser des expériences cognitives chez le sujet sain en s'appuyant sur le couplage entre activité neuronale et réponse hémodynamique (TEP, IRMf, imagerie optique) ou sur l'enregistrement direct de l'activité électrophysiologique (EEG, MEG), ouvre des horizons inespérés.
Dans cet article, nous allons chercher à faire le point sur le rôle joué par l'anatomie du cerveau humain dans les vastes projets de cartographie fonctionnelle qui ont vu le jour ces dernières années. Nous montrerons dans un premier temps le décalage actuel entre les informations architecturales sur lesquelles s'appuient usuellement les neurosciences et les informations anatomiques macroscopiques actuellement accessibles in vivo par les techniques d'imagerie. Nous donnerons ensuite un aperçu des outils informatiques permettant aujourd'hui de manipuler cette anatomie macroscopique pour la corréler avec les données fonctionnelles.
Nous évoquerons les difficultés engendrées par la variabilité interindividuelle des formes du cortex lorsqu'on souhaite les utiliser comme une « carte routière » permettant de localiser les modules fonctionnels. Nous décrirons alors les solutions mises en place par le passé pour pallier ces difficultés ainsi que leur avenir probable.
Nous montrerons que les évolutions méthodologiques pressenties tant en ce qui concerne l'analyse des données que les techniques d'imagerie pourraient permettre de se rapprocher du point de vue usuel des neurosciences. Nous insisterons enfin sur les progrès à réaliser en ce qui concerne la compréhension de la variabilité des plissements du cortex pour en étudier leur potentielle signification en terme de cartographie fonctionnelle.
1) Les structures du cerveau
Les neurosciences actuelles disposent de nombreuses techniques d'observation visant à dévoiler le fonctionnement du cerveau. L'incroyable complexité à laquelle elles sont confrontées implique un considérable effort d'analyse visant à exhiber des processus plus élémentaires et leurs diverses interactions. C'est pourquoi de nombreux travaux cherchent à mettre en évidence des structures, que ce soit sur le plan architectural ou sur le plan cognitif. Ces efforts, qui se rejoignent peu à peu, impliquent souvent des simplifications importantes, mais cette démarche réductrice semble impérative pour nourrir la réflexion.
Un point de vue architectural :
Un point de vue relativement consensuel sous-jacent aux neurosciences accorde une importance considérable à la topologie du gigantesque réseau formé par les divers types de neurones dont le cerveau est constitué [8].
Il semble complètement illusoire d'imaginer accéder un jour à la totalité de cette topologie si ce n'est pour les espèces les plus simples. Ce serait d'ailleurs sans doute d'un intérêt limité du fait de sa considérable variabilité entre les individus. En revanche, il semble fondamental de chercher à mettre en évidence ses grands principes architecturaux. D'innombrables travaux anatomiques ont été réalisés dans ce but. La plupart de ces études, qui reposent sur une vaste panoplie de colorants et de marqueurs radioactifs, sont effectuées in vitro.
La majeure partie des informations architecturales ne sont donc pas accessibles chez les sujets étudiés par imagerie fonctionnelle pour lesquels on doit se contenter de l'anatomie macroscopique révélée par l'IRM. Il semble néanmoins primordial de faire le point sur la manière dont sont actuellement prises en compte les connaissances architecturales dans les études par imagerie et de chercher à développer des moyens d'accéder à ce type d'informations in vivo.
Donner une description exhaustive de l'ensemble des connaissances actuelles sur l'architecture du cerveau dépasse largement le cadre de cet article. Nous nous contenterons d'en évoquer quelques-unes parmi les plus importantes, en nous focalisant sur le cortex :
Le cortex :
- Macroscopiquement, le cerveau se décompose de manière hiérarchique en d'innombrables sous-ensembles de neurones. On peut évoquer par exemple les nombreux noyaux enfouis dans ses profondeurs (striata, thalami ... ) et le cortex qui en constitue la couche externe. La plupart de ces structures sont visualisables en imagerie par résonance magnétique lorsque la résolution le permet. En revanche, certaines de leurs subdivisions ne le sont pas (noyaux du thalamus...). La surface du cortex présente chez l'homme de nombreux plis appelés sillons qui définissent des circonvolutions ou gyri. La complexité et la variabilité interindividuelle de la topographie sulco-gyrale du cortex en rendent la lecture particulièrement difficile. Jusqu'à présent, peu d'efforts ont été consacrés à l'étude de cette variabilité dans la mesure où on ne prête pas réellement de valeur architecturale à ces circonvolutions. Les plissements du cortex sont généralement considérés comme la réponse à un problème de « packaging » engendré par une pression évolutive conduisant à une extension de la surface corticale.
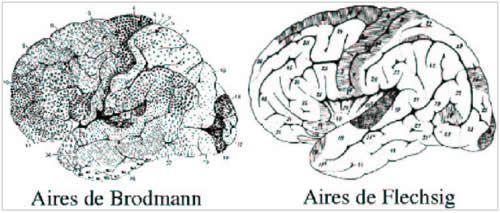
- Le néocortex :
Traditionnellement, le néocortex est considéré comme une structure à six couches incluant parfois des subdivisions. L'étude de la répartition des différents types de neurones dans ces six couches (pyramidaux, granulaires...) permet d'accéder à des informations cytoarchitectoniques qui s'avèrent particulièrement hétérogènes. Elles ont permis à divers auteurs de proposer des parcellisations de la surface corticale en une centaine d'aires [6, 79, 69, 4]. Celle de Brodmann est devenue un standard international qui permet de référencer de nombreuses études (cf. Fig. 1). L'étude de la myélinisation des fibres de la neuropile corticale ou des faisceaux afférents ou efférents fait apparaître un autre type d'hétérogénéité conduisant à d'autres cartes.
Par exemple Flechsig a mis en évidence un certain nombre d'aires en utilisant la chronologie de leur myélinisation au cours de la croissance du cerveau [19] (cf. Fig. 1). Il faut noter d'emblée le manque de connaissances sur la variabilité interindividuelle de ces diverses cartographies architectoniques et sur leurs liens avec les plis corticaux [69, 61]. Il faut également admettre le caractère relativement arbitraire des cartes proposées qui varient d'un auteur à l'autre. Cette difficulté résulte de la fréquente absence de transition abrupte entre les aires.
Fig 1 : à gauche : carte cytoarchitectonique résumant l'hétérogénéité de la répartition des différents types de neurones à travers la surface corticale; à droite : carte myéloarchitectonique résumant une hétérogénéité de la myélinisation du cortex ; les régions grisées correspondent aux aires myélinisées à la naissance.
Des techniques histologiques plus modernes permettent d'accéder à d'autres subdivisions du cortex. Par exemple des marqueurs du métabolisme mettent en évidence des « blobs » au sein de l'aire 17 de Brodmann (B17, aire visuelle primaire V1) [87] ; des techniques d'autoradiographie, qui permettent de visualiser la densité de divers neurorécepteurs, ont révélé une nouvelle subdivision de l'aire B4 (aire motrice primaire M1) [26].
De nombreux traceurs rétrogrades ou antérogrades permettent d'accéder à la connectivité du cerveau à l'échelle macroscopique [85]. Ces techniques ont mis en évidence des spécificités propres à chacune des couches corticales : les neurones de la couche 6 se projettent sur le thalamus et le claustrum, ceux de la couche 5 sur les autres structures sous-corticales ; la couche 4 reçoit les afférences thalamiques et les couches 2 et 3 sont les principales sources de projection vers d'autres aires corticales [50]. Elles ont également permis d'établir chez certaines espèces des graphes de connectivité relativement sophistiqués comme par exemple pour les aires visuelles du macaque [77]. En revanche, les données sur la connectivité du cerveau humain sont encore relativement clairsemées et rarement reliées aux cartographies fonctionnelles ou architectoniques [48, 15].
Structure du cortex :
A l'échelle microscopique, le cortex se présente comme un ensemble de mini-colonnes de quelques centaines de neurones qui s'avèrent particulièrement similaires entre les espèces [47].
Ces mini colonnes, qui correspondent à des groupes de neurones étroitement connectés, ont une organisation verticale orthogonale à l'organisation laminaire du cortex. Elles constituent le module élémentaire de son architecture. La nature des connexions entre ces modules met en évidence des entités de plus haut niveau, des macro-colonnes de 300 à 600 nm de diamètre regroupant généralement une centaine de mini-colonnes. Les grands faisceaux thalamo-corticaux et cortico-corticaux sont également dotés d'une organisation en colonnes. En effet, leurs projections sur le cortex présentent des pics dotés d'une forte densité axonale séparés par des zones beaucoup plus clairsemées.
Un outil idéal pour les études de neurosciences devrait fournir pour chaque sujet une parcellisation du cortex en aires architectoniques, une parcellisation des structures profondes comme le thalamus en noyaux élémentaires ainsi que la connectivité anatomique entre ces différentes subdivisions. Cet outil proposerait donc une vision architecturale simplifiée du cerveau se présentant sous la forme d'un graphe dont les noeuds représenteraient des ensembles de neurones et les relations des connexions synaptiques entre ces ensembles. Ce graphe pourrait d'ailleurs s'enrichir d'une dimension hiérarchique dans les régions qui recèlent plusieurs niveaux d'organisation (bandes de dominance oculaire et « blobs » de V1, regroupement de mini-colonnes corticales, noyaux du thalamus...).
La possibilité de générer une telle description structurée pour chaque individu est évidemment encore largement utopique. Elle implique par exemple la compréhension de sa potentielle variabilité entre les individus. Néanmoins, dans l'hypothèse d'une relative stabilité de cette description, elle serait un outil de choix pour référencer les travaux de cartographie fonctionnelle du cerveau humain mais également pour réaliser des comparaisons inter-espèces [54]. De telles comparaisons semblent primordiales pour rapprocher les résultats obtenus par imagerie fonctionnelle des innombrables connaissances accumulées pour les autres primates. Malheureusement, seules les informations anatomiques macroscopiques sont aujourd'hui accessibles in vivo chez l'homme.
Un point de vue cognitif sur les fonctions cérébrales
Une manière usuelle de représenter un modèle cognitif consiste d'une part à définir un certain nombre de modules, chacun respectivement responsable d'une partie particulière du processus cognitif global, d'autre part à relier ces modules par des voies de communication unilatérales ou bilatérales [13]. On voit donc de nouveau émerger des graphes dont les noeuds sont maintenant définis à partir d'un point de vue purement fonctionnel. C'est l'hypothèse d'une localisation particulière dans le cerveau du réseau de neurones associé à un de ces modules qui permet d'espérer sa mise en évidence en imagerie fonctionnelle ou dans une étude de neuropsychologie classique. Le raisonnement qui fonde alors la conception d'une expérience et l'analyse de ses résultats est souvent structurel par essence. Cet aspect est particulièrement frappant dans l'étude des conséquences d'une lésion focale sur le comportement. On parle ainsi de dissociation lorsqu'un patient cérébrolésé a perdu les capacités supputées d'un des modules du modèle cognitif mais conserve celles des autres modules [13]. Un exemple célèbre qui a validé l'existence de V5 chez l'homme correspond à une patiente ayant perdu la faculté de « voir » les objets en mouvement sans atteinte du reste de sa vision [88, 87]. Il faut noter que cette démarche peut se heurter à des problèmes de résolution car deux modules putatifs peuvent être très proches dans le cerveau voire indissociables. Sur le plan de la connectivité, l'étude des « split-brains » ayant subi une section des commissures entre les deux hémisphères cérébraux permet de valider d'autres aspects des modèles cognitifs [25].
Vers la convergence de ces deux points de vue
Il semble s'être établi un consensus sur l'existence de liens étroits entre les parcellisations architecturales évoquées plus haut et les modules des graphes cognitifs modèles pour ce qui concerne les aires primaires [77, 87]. Par exemple, l'aire visuelle primaire correspond à l'aire cytoarchitectonique B17.
De nombreuses expériences ont également montré l'importance fonctionnelle de la notion de colonne corticale. Ces études ont montré que dans les aires dont on pouvait mettre en évidence l'organisation interne (rétinotopie, somatotopie ... ), les neurones d'une même colonne corticale répondaient tous à la même valeur des paramètres sous-jacents à cette organisation (point du champ visuel, partie du corps...). En revanche, il est encore difficile de tirer des conclusions pour les aires de plus haut niveau et plus particulièrement pour celles qui sont propres à l'homme. En effet, les parcellisations architecturales des régions potentiellement impliquées sont encore relativement frustes et les « modules cognitifs » sous-jacents pourraient correspondre à des réseaux de neurones plus distribués ou plus imbriqués que dans les régions primaires.
2) La situation actuelle en imagerie fonctionnelle
Alors que le monde des neurosciences aurait été naturellement enclin à aborder le problème de la cartographie fonctionnelle du cerveau avec un point de vue structurel, que ce soit à cause de la nature du substrat anatomique ou de celle des modèles cognitifs proposés, le monde de l'imagerie fonctionnelle n'a pas encore été réellement en mesure d'inclure ce type de préoccupations dans les méthodologies qu'il met en oeuvre. Cela s'explique d'une part historiquement par la qualité relative des premières images fonctionnelles (faible résolution spatiale, mauvais rapport signal sur bruit), d'autre part par l'impossibilité d'accéder in vivo aux informations anatomiques de type architectural (cyto et myéloarchitectonies, connectivité) et par le peu de connaissances disponibles sur les liens potentiels entre ces informations et l'anatomie sulco-gyrale.
Corrélation anatomo-fonctionnelle individuelle
Depuis quelques années, des techniques de recalage automatique permettent d'apparier point à point une image fonctionnelle avec une image anatomique du même sujet acquise par IRM [38] (cf. Fig.2). Il est alors possible de localiser les informations fonctionnelles par rapport à l'anatomie macroscopique individuelle de ce sujet. Cette potentialité est particulièrement utilisée pour les applications cliniques : localisation des régions corticales motrices ou liées au langage à préserver au cours d'un acte chirurgical [65, 34], suivi de l'évolution de la densité de récepteurs dopaminergiques dans les striata à la suite de greffes neuronales chez des malades parkinsoniens [66], étude du métabolisme de l'hippocampe dans les épilepsies temporo-mésiales [70]. De nombreux outils d'analyse d'images ont été développés ces dernières années pour faciliter de telles corrélations anatomo-fonctionnelles. Il s'agit d'outils de segmentation proposant par exemple une délimitation automatique de certaines structures profondes ....................
[59] ou du cerveau et de ses hémisphères [41, 43]. Ces segmentations permettent entre autres d'accéder à des visualisations tridimensionnelles qui facilitent par exemple le planning chirurgical (cf Fig. 2).
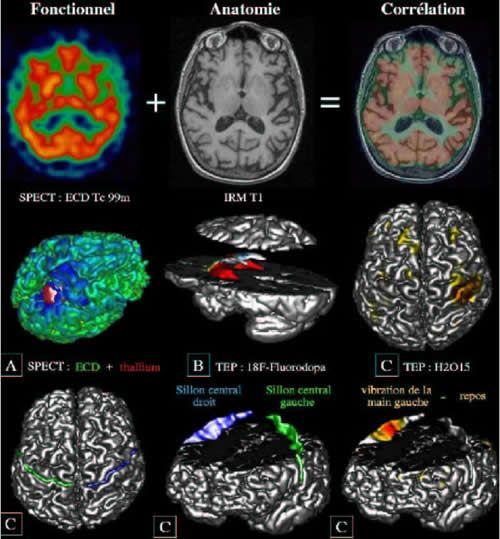
Fig 2 : Le recalage entre des images du même sujet issues de modalités anatomiques (IRM) et fonctionnelles (TEP, SPECT , IRMf. ..) permet d'effectuer des corrélations anatomo-fonctionnelles précises. Ce type d'approche est particulièrement utilisé pour les applications cliniques. A : une image SPECT de thallium met en évidence une tumeur, une image SPECT d 'ECD décrit ses conséquences au niveau de la perfusion du cerveau. La corrélation avec l'anatomie permet un planning précis de la biopsie qui décidera de la nature exacte de cette tumeur (Val de Grâce/SHFJ). B : Des images TEP de fluorodopa permettent d'estimer la densité des récepteurs dopaminergiques dans les striata. Ce type d'information permet par exemple d'évaluer le succès de greffes neuronales dans le traitement de la maladie de Parkinson (CHU Henri Mondor/SHFJ) [66]. C : Localisation de l'aire somesthésique primaire de la main par rapport au sillon central dont le fond est un bon repère de la transition entre l'homonculus moteur et l'homonculus somesthésique [53]. La localisation des aires sensori-motrices est importante pour certains actes chirurgicaux qui cherchent à les préserver.
Les besoins de la cartographie
Les expériences réalisées à des fins de cartographie requièrent en outre la possibilité de comparer des individus et de thésauriser les résultats obtenus en matière de localisation anatomique par rapport à un référentiel. Le premier problème auquel elles se heurtent réside dans la variabilité interindividuelle des formes du cerveau. En effet, comparer les images fonctionnelles issues de plusieurs individus nécessite un appariement préalable entre leurs cerveaux. De nombreuses manières de réaliser un tel appariement sont actuellement étudiées. La plupart visent à faire disparaître la variabilité des formes macroscopiques de manière à se ramener à une situation où tous les cerveaux seraient anatomiquement point par point identiques. On parle alors de « normalisation spatiale » [23]. On peut également réaliser des appariements sur un plan plus cognitif en comparant directement les cartes d'activations fonctionnelles individuelles. Ce dernier type d'analyse reste d'ailleurs encore souvent cantonné au stade de la réflexion. On peut néanmoins observer l'émergence de nouvelles approches algorithmiques visant à assister cette réflexion [10].
Valeur fonctionnelle de l'anatomie sulco-gyrale
Parmi les repères macroscopiques susceptibles de guider la normalisation spatiale, tous ne détiennent pas une valeur architecturale reconnue. On peut en particulier s'interroger sur la nécessité de fonder l'appariement de deux cortex sur les détails de l'anatomie sulco-gyrale. En effet, bien que quelques grands sillons soient généralement considérés comme de bons indices de la localisation de certaines transitions architectoniques ou fonctionnelles, il est rarement envisagé que cette propriété soit extrapolable à l'ensemble des plis corticaux. Il est d'ailleurs difficile de tester cette hypothèse de manière systématique dans la mesure ou la simple identification de certains sillons pose souvent de considérables difficultés. En effet, la plupart des sillons corticaux peuvent présenter diverses interruptions conduisant à une grande variabilité des formes des circonvolutions [51] (cf. Fig 3).
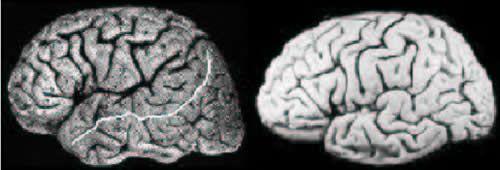
Fig 3 : La variabilité interindividuelle des plissements du cortex est considérable. Actuellement, l'origine de cette variabilité est loin d'être claire ce qui pose d'importants problèmes pour la cartographie fonctionnelle du cortex. Il est par exemple particulièrement difficile de trouver dans le cerveau de droite un analogue au grand sillon surligné de blanc dans le cerveau de gauche [17].
Bien que les difficultés propres à la variabilité de la topographie du cortex humain aient engendré un relatif désintérêt pour sa potentielle signification en terme d'organisation fonctionnelle, de nombreux travaux chez des espèces dont le cortex présente un moindre degré de gyrification et une moindre variabilité topographique conduisent à attribuer aux gyri corticaux une valeur organisationnelle similaire par exemple à celle des noyaux du thalamus. Une bibliographie relativement exhaustive sur le sujet a été proposée par Welker [8 1 ]. Parmi les multiples arguments sur lesquels s'appuie cette hypothèse, on peut évoquer rapidement les suivants [64]:
-la variabilité intra-espèce de la topographie sulco-gyrale du cortex est bien moindre que la variabilité inter-espèces ; en outre, l'importance des similitudes inter-espèces est inversement proportionnelle à la distance phylogénétique ;
-certaines transitions architectoniques correspondent à un pli cortical ;
-il existe de nombreuses différences architecturales entre les fonds des sillons et les sommets des gyri en ce qui concerne d'une part l'organisation en couches et en colonnes de la surface corticale, d'autre part la connectivité;
-les plis secondaires apparaissant au sein d'un gyrus définissent souvent des sous-gyri dotés d'afférences et d'efférences distinctes ;
-des études électrophysiologiques réalisées dans les aires somesthésiques de nombreuses espèces ont montré que même lorsque la topographie des plis corticaux varie, ceux-ci délimitent systématiquement des territoires cutanés distincts, par exemple deux doigts de la patte ;
-les aires primaires sont généralement enfouies dans les plus grands sillons.
Chacun de ces arguments pris indépendamment peut facilement se voir opposer un contre-exemple visant à prouver que les plissements du cortex ne résultent que de contraintes purement mécaniques. C'est leur convergence qui conduit à penser que parmi la multitude des processus de croissance à l'oeuvre durant l'ontogenèse et l'épigenèse, certains mécanismes contribuent à faire de la topographie sulco-gyrale un reflet de l'organisation fonctionnelle du cortex. On peut d'ailleurs noter que des contraintes mécaniques liées aux tensions induites par la mise en place de la connectivité du cortex pourraient elles même en partie induire une telle corrélation [78].
Chez l'homme, le processus de gyrification est considérablement amplifié par rapport aux espèces classiquement étudiées. Des hétérogénéités importantes de la vitesse d'expansion du cortex en provoquent l'enfouissement de portions entières dans de grandes fissures. En outre, les plissements secondaires apparaissant durant les derniers stades de la croissance s'avèrent extrêmement variables d'un individu à l'autre. Ce dernier phénomène ne va d'ailleurs pas à l'encontre de l'hypothèse du paragraphe précédent puisqu'il pourrait simplement révéler une certaine variabilité interindividuelle de la cartographie fonctionnelle sous-jacente. Actuellement, très peu d'études par imagerie fonctionnelle ont cherché à étudier la corrélation entre les cartes d'activations et les topographies sulco-gyrales individuelles. Celles qui abordent réellement le sujet ont pourtant mis en évidence des localisations anatomiques très précises (V5 [80], aire motrice primaire de la main [65, 3, 86], FEF [35]).
Anatomie sulco-gyrale du cerveau
Les difficultés engendrées par la variabilité de l'anatomie sulco-gyrale lorsqu'on cherche à la déchiffrer à travers des coupes IRM expliquent en grande partie la rareté de ce type d'études. Une nouvelle génération d'outils de segmentation visant à faciliter la manipulation et l'identification des plis corticaux a été développée ces dernières années en France [39, 32, 68]. Ces outils donnent accès à de nouveaux moyens de visualisation dédiés à des corrélations anatomo-fonctionnelles précises (cf. Fig 2, 3 et 4). Certains permettent déjà une identification automatique des plus grands sillons [40, 33]. Malheureusement, l'objectif d'une reconnaissance automatique de l'ensemble des structures sulco-gyrales butte actuellement sur les limites des descriptions anatomiques usuelles qui ne proposent pas d'interprétation à la considérable variabilité des plissements corticaux [5 1 ]. Ces difficultés qui nous ont conduit à développer un programme de recherche à long terme qui vise à faire émerger un modèle générique de l'anatomie sulco-gyrale qui permette réellement d'étudier ses liens potentiels avec les cartographies architectoniques et fonctionnelles [64, 65, 37, 42]. Avant d'évoquer l'état d'avancement de ce travail, nous allons d'abord chercher à faire le point sur les diverses alternatives qui se développent actuellement dans le monde de l'imagerie fonctionnelle pour procéder à l'appariement de plusieurs cerveaux et définir des systèmes de référence. Il sera particulièrement intéressant de constater la position relativement ambiguë de la plupart des méthodes proposées vis-à-vis des nombreuses difficultés liées à la prise en compte de l'anatomie sulco-gyrale.
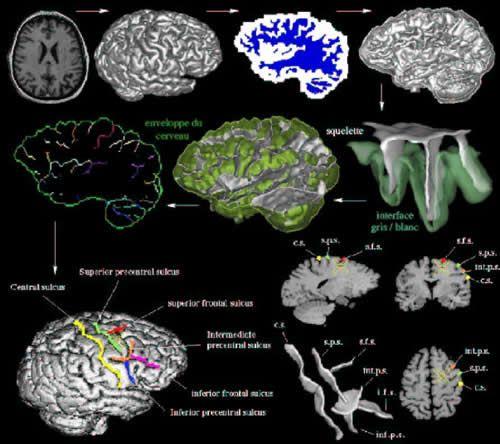
Fig 4 : Des techniques d'analyse d'images principalement issues du domaine de la morphologie mathématique permettent d'extraire automatiquement des images brutes les différents plis du cortex. L'idée sous-jacente consiste à construire dans un premier temps un moule en négatif du cortex, puis à découper ce moule de manière à pouvoir visualiser individuellement chacun des plis. Ces plis sont assemblés dans une structure synthétique qui résume la topographie du cortex. Des méthodes de reconnaissances des formes permettent alors d'identifier automatiquement les principaux sillons.
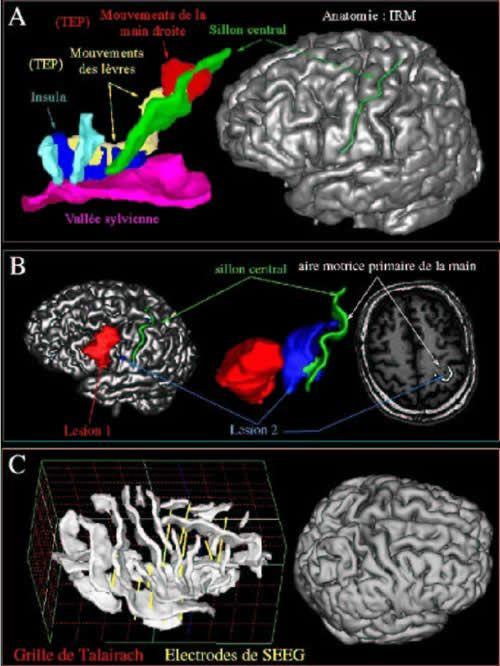
Fig 5 : Des outils de navigation sophistiqués permettent de constituer des scènes 3D combinant des informations sulco-gyrales et des informations fonctionnelles. Ils permettent diverses utilisations. A : Localisation précise d'activations fonctionnelles parfois enfouies dans les profondeurs des plissements corticaux. B : Localisation sulco-gyrale de l'étendue des lésions vasculaires ; dans cet exemple, une excroissance de la lésion 2 dans le genou du gyrus précentral supposé correspondre à l'aire motrice primaire de la main [86] s'accompagnait effectivement d'un déficit moteur de la main droite [11] (La Salpétrière/SHFJ). C : La prise en charge neurochirurgicale des épilepsies pharmaco-résistantes peut impliquer un processus complexe. Dans un premier temps, l'étude de la sémiologie des crises, des enregistrements EEG, vidéo, et éventuellement des images du métabolisme permettent d'effectuer un certain nombres d'hypothèses sur les régions potentiellement impliquées dans le réseau épileptogène. On procède ensuite à l'implantation d'électrodes profonde (SEEG) qui vont permettre de sélectionner la bonne hypothèse qui conduira éventuellement dans un second temps à une cortectomie. Une phase de planning associant des informations sulco-gyrales et le système de Talairach permet d'optimiser la trajectoire des électrodes en fonction de connaissances a priori sur les corrélations anatomo -fonctionnelles [64] (La Timone/SHFJ).
3) La normalisation spatiale des structures et aires du cerveau
L'approche proportionnelle
Avant l'avènement de techniques d'imagerie anatomique comme le scanner X et surtout l'IRM, seuls les neurochirurgiens étaient susceptibles d'accéder aux formes complexes du cortex in vivo. Néanmoins, du fait des connaissances alors relativement rudimentaires sur son organisation fonctionnelle, ils ne manifestaient qu'un faible intérêt pour une analyse fine de l'anatomie sulco-gyrale. Quelques grands repères suffisaient en effet pour localiser grossièrement les aires sensori-motrices primaires et les régions périsylviennes associées au langage. Pourtant, certaines écoles de stéréotaxie ressentirent le besoin d'une anatomie beaucoup plus précise du cortex, notamment dans le domaine très spécialisé de la chirurgie de l'épilepsie. Ainsi, les travaux remarquables de l'école de Sainte-Anne montrèrent l'intérêt de la ventriculographie pour détecter deux points de repère profonds permettant d'orienter un cerveau quelconque de manière relativement stable [72]. Associée à quelques facteurs de proportionnalisation destinés à s'affranchir de la variabilité des dimensions globales du cerveau, cette orientation standard permettait de définir un référentiel commun à tous les individus doté d'un système de coordonnées tridimensionnel (cf Fig. 6).
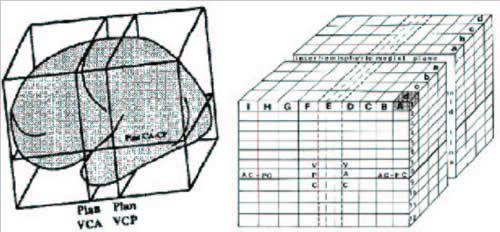
Fig 6 : La méthode proportionnelle proposée par Talairach dans les années soixante permet d'utiliser un système de coordonnées tridimensionnel pour se repérer dans le cerveau. Les approches aujourd'hui utilisées pour cartographier le cerveau s'inspirent de cette méthode.
Le référentiel de Talairach s'avère particulièrement efficace lorsqu'il s'agit de prédire la localisation des structures profondes du cerveau (noyaux du thalamus...). En revanche, sa précision se réduit considérablement lorsqu'il s'agit de localiser les structures corticales, mais l'utilisation conjointe d'artériographies stéréotaxiques mettant en évidence les boucles intra-sulcales des artères permettait d'identifier les principaux sillons [7 1 ]. Cette approche originale n'a pourtant connu qu'une diffusion limitée du fait de son caractère invasif et des difficultés pratiques liées à sa mise en oeuvre. L'apparition des techniques de tomographie anatomiques et fonctionnelles et les besoins engendrés par les projets de cartographie fonctionnelle ont remis au goût du jour l'idée de référencer une position dans le cerveau à l'aide d'un système proportionnel [73].
L'essor de l'imagerie fonctionnelle d'activation dans les années 80 et au début des années 90 reposait essentiellement sur des études en eau marquée par TEP. L'impossibilité de multiplier les acquisitions chez un même sujet du fait de la dose injectée, ainsi que la nature du phénomène physique utilisé pour réaliser les images conduisaient à des données trop bruitées pour espérer en inférer une information individuelle fiable. Cette situation a conduit Fox à proposer l'idée de normaliser spatialement les images issues de plusieurs individus de manière à supprimer autant que faire se peut la variabilité des formes anatomiques [20]. Il s'agit en fait de déformer chaque image individuelle de manière à la faire entrer dans un référentiel standard, du style de celui de Talairach. La démarche la plus usitée consiste à déterminer une déformation globale de l'image individuelle qui minimise une distance avec une image modèle (« template ») [23]. Celle-ci est précalculée en moyennant un ensemble d'images individuelles préalablement placées dans le même référentiel à l'aide d'une méthode ad hoc éventuellement interactive. Après cette normalisation spatiale, on peut comparer point par point les images fonctionnelles issues de plusieurs individus. Cette approche a permis d'appuyer les études d'activation interindividuelles sur une batterie d'outils statistiques robustes qui associent aux résultats obtenus une valeur de confiance. La très large diffusion du logiciel proposant ces outils (SPM) et sa souplesse d'utilisation ont amené cette démarche à un niveau de maturité qui en font un standard du monde du « brain mapping » [22].
L'alternative des régions d'intérêt
Le concept de normalisation spatiale a néanmoins soulevé dès le départ un certain nombre de questions justifiant des démarches différentes, par exemple des analyses par régions d'intérêt [76]. En effet, on pouvait s'interroger sur le bien-fondé d'une comparaison interindividuelle point à point après une normalisation qui n'amène pas nécessairement en correspondance des aires équivalentes. Il faut d'ailleurs noter que la normalisation spatiale est systématiquement associée à un lissage important des données fonctionnelles de manière à réduire les conséquences de ses insuffisances. L'alternative des régions d'intérêt vise en fait à fonder la normalisation non pas sur un référentiel de type Talairach mais sur une parcellisation anatomique du type de celle évoquée dans le premier chapitre de cet article. Malheureusement, la parcellisation utilisée ne s'appuie pas sur une cartographie architectonique mais sur des structures sulco-gyrales dont la signification en terme d'organisation fonctionnelle est loin d'être universellement admise. En outre, la complexité et la variabilité de l'anatomie sulco-gyrale ne permettent actuellement qu'une parcellisation grossière, chaque parcelle pouvant potentiellement inclure de nombreuses aires fonctionnelles d'où une importante perte de sensibilité dans les analyses statistiques.
Les nouvelles potentialités issues de l'IRM fonctionnelle
L'avènement de l'IRM fonctionnelle a considérablement relancé le débat sur la normalisation spatiale. En effet, cette modalité permet de multiplier les images chez un même sujet et ainsi de disposer de suffisamment de puissance statistique pour réaliser une détection individuelle des activations. Dès lors, la normalisation n'est plus nécessaire lorsqu'on s'intéresse uniquement à l'aspect détection. En revanche, la normalisation est toujours amplement pratiquée lorsqu'on souhaite effectuer une analyse interindividuelle, celle-ci s'avérant souvent cruciale, au moins dans un premier temps, pour obtenir une vision synthétique du résultat d'un protocole. La normalisation est également énormément utilisée pour réaliser des méta-analyses sur un ensemble de protocoles pouvant inclure des données de la littérature. Dans un second temps, on cherche souvent à revenir aux activations individuelles de manière à étudier leur localisation anatomique, à comparer les résultats de différentes études chez le même sujet ou à appréhender la variabilité interindividuelle.
Apports et limites de la normalisation classique
La notion de normalisation spatiale a eu un impact considérable sur la manière d'aborder les études par imagerie fonctionnelle. En effet, si historiquement la normalisation a été introduite avant tout pour des raisons statistiques, elle a acquis aujourd'hui un statut d'outil standard de confrontation avec la littérature. Elle permet d'utiliser la grille proportionnelle de Talairach comme système de coordonnées standard pour localiser les activations. Elle a ainsi fourni à la communauté des neurosciences un outil de communication sans précédent qui n'est pas étranger à l'essor actuel [21]. Elle est venue pallier les difficultés induites par la complexité et la variabilité de l'anatomie sulco-gyrale lorsqu'il s'agit de localiser précisément une activation. Elle a été d'ailleurs d'autant plus facilement acceptée qu'en l'absence d'informations architectoniques, les informations sulco-gyrales sont loin d'être uniformément admises comme étant une alternative fournissant des repères stables par rapport à la cartographie fonctionnelle. La normalisation spatiale actuelle induit néanmoins un biais certain dans la manière de percevoir les données fonctionnelles. Il faut noter que malgré son succès, de nombreux utilisateurs référencent également leurs activations à l'aide de la nomenclature de la cartographie architectonique de Brodmann. Malgré le coté relativement arbitraire du procédé de conversion utilisé pour passer des coordonnées proportionnelles au système de Brodmann, cette opération semble nécessaire pour se ramener à des bases connues des neurosciences, par exemple aux résultats obtenus chez le singe en enregistrant directement l'activité neuronale.
4) L'avenir de la normalisation spatiale conventionnelle
Peut-on parfaire la normalisation spatiale actuelle ?
De nombreuses équipes cherchent à améliorer la manière classique de normaliser les images spatialement. Il est difficile de faire une synthèse de toutes les voies explorées mais on peut néanmoins lister les principales. La plus répandue consiste à complexifier la déformation des images de manière à obtenir une mise en correspondance parfaite de toutes les structures cérébrales avec le modèle [46, 1]. Cette démarche atteint en fait rapidement ses limites du fait de l'incompréhension actuelle de la variabilité de l'anatomie corticale humaine. En effet, dans certaines régions, on ne sait pas réellement comment devrait être réalisée la mise en correspondance et les travaux méthodologiques dérivent souvent vers une approche de type « morphing » sans réelle justification anatomique. En outre, il est peu probable que chercher à trouver une correspondance point à point entre deux cerveaux ait un sens du point de vue architectural ou cognitif du fait de la variabilité interindividuelle.
Du point de vue des neurosciences, le problème de la normalisation spatiale ne devrait pas être défini par rapport à l'anatomie sulco-gyrale mais comme une mise en correspondance des aires corticales. Toute la difficulté réside dans le flou artistique qui se cache derrière les termes « aire corticale ». Fait on référence à une notion anatomique de type cyto-architectonique ou à une notion plus cognitive ? En outre, rien ne prouve que l'organisation cyto-architectonique ou cognitive du cerveau soit stable d'un individu à l'autre. Il faut en effet prendre conscience que des cartographies comme celle de Brodmann n'ont été réalisées que sur quelques cerveaux. Il est donc actuellement impossible d'en évaluer la variabilité ou les liens avec l'anatomie sulco-gyrale. Par exemple, la topologie des aires (leurs adjacences respectives) pourrait varier dans certaines régions ce qui rendrait caduque l'idée de gommer cette variabilité à l'aide d'une déformation continue.
Un atlas probabiliste des aires cyto-architectoniques, grâce au brain mapping
Consciente des limites d'une normalisation spatiale uniquement fondée sur les formes macroscopiques du cerveau, la communauté du « brain mapping » a initié depuis quelques années des travaux visant à constituer des atlas probabilistes susceptibles de représenter la variabilité résiduelle après normalisation. On assiste à deux démarches en partie concurrentes. Celle d'un groupe d'équipes européennes vise à constituer un atlas de la variabilité des aires architectoniques après normalisation [67]. Ce projet est particulièrement lourd dans la mesure où il implique un traitement in vitro des cerveaux. Outre l'atlas proprement dit, il pourrait également déboucher sur une étude systématique des corrélations entre anatomie sulco-gyrale et parcellisation architectonique qui influerait considérablement sur la manière d'aborder le problème de la normalisation. Il faut insister sur l'importance de cette question pour l'avenir méthodologique du « brain mapping » et sur l'intérêt de tenter de révéler des informations architectoniques par imagerie. Il n'est d'ailleurs pas invraisemblable d'imaginer que certaines informations architecturales puissent provenir un jour de l'imagerie des densités de neurorécepteurs corticaux par TEP à partir d'une démarche analogue à celle aujourd'hui utilisée en autoradiographie [26].
Un atlas probabiliste des structures corticales, grâce au brain mapping
Le continent nord américain et plus particulièrement le MNI du McGill (Montréal) développe des approches s'intéressant à l'anatomie macroscopique [45]. Ainsi, des atlas probabilistes de la localisation de certains sillons, d'une parcellisation anatomique en volume d'interêts et de l'épaisseur du cortex ont été récemment constitués [60]. Le MNI étant à l'origine des principaux « templates anatomiques » de SPM, ces atlas probabilistes devraient rapidement être diffusés dans la communauté du « brain mapping ». Leur utilisation pour l'analyse des données fonctionnelles n'est pas encore très claire. En revanche, ils devraient apporter une aide considérable pour l'analyse des anatomies individuelles. Une autre utilisation potentielle des atlas probabilistes réside dans la comparaison de deux populations (sujet sains / pathologie, homme / femme...).
Une identification préalable des structures corticales
Une approche similaire est développée à l'UCLA avec la volonté sous-jacente de concevoir une nouvelle méthode de normalisation incluant la mise en correspondance de quelques grands sillons dans les contraintes imposées aux déformations [74]. Ce second projet utilise non seulement des IRM mais aussi des données de meilleure résolution issues de la cryosection [Toga]. Il illustre un des avenirs probables de la normalisation qui consiste à choisir parmi l'infinité des « morphings » possibles entre deux cortex une déformation qui apparie des repères analogues définis à partir de l'anatomie sulco-gyrale. Le développement de telles méthodes achoppe actuellement sur les difficultés engendrées par la variabilité interindividuelle de l'anatomie corticale. Cette situation explique les efforts entrepris depuis plusieurs années au SHFJ en collaboration avec le D. Jean Régis de La Timone pour trouver des explications à cette variabilité [65, 42]. Un modèle générique de l'anatomie corticale du type de celui que nous tentons de valider ouvrirait de nouvelles perspectives pour les méthodes de « morphing » qui cherchent à s'ancrer sur une interprétation anatomique préalable.
Déplier le cortex
Un dernier type d'approche s'inspire des méthodes des géographes. L'idée consiste à utiliser la topologie surfacique du cortex pour réduire le problème du référentiel d'une dimension. Le cortex est dans un premier temps « gonflé » de manière à le déplier, ce qui fournit un moyen d'en visualiser les profondeurs et d'appréhender en quelques images la totalité d'une carte d'activation initialement volumique [75]. Il est ensuite aplati après avoir subi quelques déchirures le long du fond de certains sillons de manière à pouvoir être représenté avec le minimum de déformations [ 16]. Il est enfin déformé afin de mettre en correspondance certains sillons avec ceux du cortex du « Visible Man » qui a subit le même sort. Ce cortex de référence a été doté d'un système de coordonnées 2D similaire à celui de la grille proportionnelle. Cette approche, qui fournit une alternative à la grille 3D, permet en outre des comparaisons avec des cartes similaires réalisées chez diverses espèces à partir de méthodes de cartographie invasives (enregistrements, cyto-architectonie ... ) [49, 31]. Malheureusement, cette normalisation bidimensionnelle souffre des même défauts que son alter ego tridimensionnelle : elle ne donne pas accès à des informations architecturales.
5) Une vision structurelle de la normalisation spatiale du cerveau
Appariement des activations individuelles
Il faut noter que les équipes n'utilisant pas un outil de normalisation spatiale de type SPM pratiquent néanmoins des « études de groupes » dans le sens où elles recherchent dans l'ensemble des activations individuelles celles qui semblent reproductibles d'un individu à l'autre. Cette recherche s'effectue alors souvent de manière empirique en utilisant grossièrement la localisation anatomique des activations pour les apparier entre les individus. Une différence fondamentale avec l'approche de SPM réside dans la manière de réaliser ces appariements. Ici, ce sont directement des groupes de points connexes qui sont mis en correspondance et non pas des pixels. Cette opération est justifiée par l'hypothèse que chaque groupe représente éventuellement un des modules du modèle cognitif sous-jacent à l'expérience.
Cette manière de procéder, qui peut s'appuyer sur les outils statistiques de SPM pour mettre en évidence les groupes activés chez chaque individu [55, 56, 57], est beaucoup plus souple à maints égards. C'est le chercheur lui même qui gère la normalisation spatiale à travers sa propre lecture des anatomies individuelles. Ainsi, un neuro-anatomiste peut choisir à sa guise les repères anatomiques qu'il souhaite apparier entre les individus. Le cognitiviste peut même faire l'hypothèse d'une variabilité non négligeable de la localisation anatomique de certaines aires fonctionnelles, ce qui n'est pas à exclure par exemple pour les aires associées à l'apprentissage tardif d'une seconde langue [14]. Il peut aussi tenir compte de connaissances a priori sur la cartographie fonctionnelle du cerveau issues par exemple de l'étude des conséquences de lésions focales. Enfin, nous verrons plus loin que de nouveaux outils pourraient apporter des informations supplémentaires pour guider les appariements à travers l'étude de la connectivité potentielle entre les aires activées.
Manipulation de l'anatomie sulco-gyrale du cerveau
Depuis quelques années, nous développons au SHFJ des outils de manipulation structurelle de l'anatomie sulco-gyrale 3D qui visent à assister le cognitiviste au cours de ces opérations d'appariements contraints par l'anatomie [39]. Ces outils permettent de naviguer en 3D dans des graphes dont les noeuds correspondent aux plis corticaux. Il est alors possible de constituer des scènes associant un certain nombre de plis ou reconstituant certains gyri et d'y insérer les activations issues du même individu de manière à estimer précisément leur localisation sulco-gyrale. Ces outils permettent également de mixer simplement le résultat de plusieurs expériences réalisées chez le même sujet. A l'avenir, ces diverses opérations pourront être réalisées simultanément sur plusieurs sujets de manière à faciliter les appariements. L'utilisateur pourra alors spécifier les modèles cognitifs reconnus ou postulés impliqués par son expérience et se servir directement des modules qu'ils décrivent pour étiqueter les activations. Il disposera donc de bases de données d'activations et de structures sulco-gyrales indexées par les modèles cognitifs et les modèles anatomiques qui devraient considérablement l'assister dans sa réflexion. Ce potentiel permettra de progresser tant sur le plan des modèles cognitifs que sur celui des modèles de l'anatomie corticale et de ses liens potentiels avec la cartographie fonctionnelle.
Automatisation des appariements
Par ailleurs nous cherchons à systématiser le processus d'analyse de groupe d'inspiration structurelle en développant des méthodes qui permettent d'effectuer les appariements d'activation de manière automatique [9, 10]. Ces méthodes disposent de suffisamment de souplesse pour permettre d'intégrer divers types de contraintes anatomiques : distance faible après normalisation spatiale, proximité d'une structure anatomique, localisation dans un gyrus particulier. Elles permettraient également d'intégrer facilement des contraintes issues du modèle cognitif (connectivité, spécificité de la réponse hémodynamique, a priori sur l'agencement topologique d'un groupe de modules du modèle...). A terme, il s'agira de fournir au cognitiviste un moyen d'interroger sa base de données de manière sophistiquée en choisissant lui même les a priori à injecter dans les appariements (graphe cognitif modèle, localisation anatomique lâche pour une entité, précise pour une autre...). La systématisation du processus devrait permettre de fournir à l'utilisateur une mesure de confiance dans un appariement donné.
Conclusion sur la normalisation spatiale du cerveau
L'avenir de la normalisation spatiale semble s'articuler autour de deux principales alternatives. La première consiste à poursuivre dans la direction actuellement proposée par SPM en imposant à la normalisation l'appariement de certains repères anatomiques précis. De nombreuses équipes se sont engagées dans cette voie. Elle implique des progrès dans la compréhension de la variabilité inter-individuelle de l'anatomie sulco-gyrale du type de ceux qui seront évoqués dans le chapitre suivant. La seconde alternative pour le futur de la normalisation s'écarte de la précédente et cherche à se rapprocher de la nature des raisonnements menés par les spécialistes des neurosciences. Elle repose sur l'idée de manipuler directement les activations et les structures anatomiques individuelles. En se situant au niveau de ces objets plutôt qu'au niveau des voxels, elle permettra d'injecter divers a priori issus des modèles structurels anatomiques, architecturaux et cognitifs dans les analyses de groupes. Elle est en outre plus à même que la précédente d'intégrer d'autres évolutions méthodologiques émergentes, évoquées dans le dernier chapitre de cet article, qui visent d'une part à multiplier les expériences cognitives chez un même sujet, d'autre part à accéder in vivo à des informations sur la connectivité anatomique.
6) Vers un modèle générique de l'anatomie sulco-gyrale du cerveau
L'hypothétique invariance de l'organisation du cortex
Dans les chapitres précédents, nous avons évoqué à de nombreuses reprises les difficultés engendrées par la variabilité interindividuelle de l'anatomie sulco-gyrale. Ces difficultés nous ont incités à développer un programme de recherche qui vise à mieux comprendre cette variabilité de manière à pouvoir en maîtriser les conséquences. Il est important de noter qu'étudier de manière cohérente les liens potentiels entre l'anatomie sulco-gyrale et les cartographies fonctionnelle ou architecturale implique de tels progrès.
Nous avons listé plus haut un certain nombre d'observations qui nous conduisent à voir dans la topographie sulco-gyrale du cortex une trace de son organisation fonctionnelle. Ce point de vue fait l'hypothèse que les nombreux processus qui conduisent aux plissements de la surface corticale durant l'ontogenèse et l'épigenèse sont intimement liés à cette organisation. Une conclusion hâtive conduirait alors à déduire de la variabilité anatomique illustrée par la figure 3 l'existence d'une considérable variabilité de l'organisation fonctionnelle entre les individus. Nous pensons au contraire que les phénomènes illustrés par cette figure ne traduisent qu'une variabilité mineure de cette organisation liée au développement plus ou moins important de certains modules architecturaux. Il s'agit d'une seconde hypothèse qui intègre celle d'une corrélation anatomo-fonctionnelle précise et y ajoute l'invariance entre les individus de l'organisation générale du cortex pour des raisons d'ordre génétique.
Les profondeurs du cortex
Cette seconde hypothèse est bien évidemment encore plus difficile à valider que la première. Un premier pas vers une telle validation consisterait à montrer que la variabilité de la topographie sulco-gyrale du cortex humain est bien moindre qu'elle n'y paraît au premier abord. Nous pensons que le point de vue généralement adopté pour décrire cette variabilité conduit à en exagérer l'ampleur [5 1 ]. En effet, la description de l'aspect des sillons corticaux qui découle de l'observation de la surface externe du cortex néglige d'importantes informations enfouies dans ses profondeurs [64]. Ainsi, nous pensons que l'interruption d'un sillon correspond à l'émergence à la surface d'un pont de substance blanche dénommé usuellement « pli de passage » par les anatomistes. Ces « plis de passage », qui contiennent des fibres d'association courtes intergyrales dites « en U », ne diffèrent en fait en rien des gyri généralement visibles depuis l'extérieur. On parle d'ailleurs parfois de « gyrus annectant ».
Accéder aux formes tridimensionnelles des plis corticaux permet d'observer diverses déformations qui semblent révéler la présence de ces plis de passage [42] (cf. Fig 7). L'utilisation des nouveaux moyens de visualisation dont nous disposons associée à une synthèse de la littérature sur les différentes interruptions des principaux sillons décrites à ce jour nous ont permis de réaliser une première cartographie de ces plis de passage [64]. Les schémas obtenus révèlent une étonnante stabilité entre les individus qui peut être interprétée comme une illustration d'une hypothétique invariabilité de la connectivité corticale [64, 36]. Ils nous ont conduits à proposer une description générique de l'organisation gyrale du cortex dont il serait possible de retrouver la trace dans n'importe quel cortex individuel.
Les racines sulcales du cortex
Les paragraphes précédents portent sur une description de l'organisation gyrale du cortex. Cette description est relativement difficile à manipuler car elle ne définit pas clairement la notion de gyrus d'un point de vue morphologique. Il faut en effet noter qu'elle met avant tout l'accent sur la connectivité gyrale. Un point de vue dual axé sur une description des plissements corticaux est souvent préférable lorsqu'on cherche à décrire la topographie corticale. En effet, bien que les hypothétiques modules architecturaux du cortex correspondent aux gyri, il est beaucoup plus aisé de définir les plis qui les séparent. En outre, chercher à comprendre la manière dont la topographie corticale se met en place au cours de la croissance du cerveau amène naturellement à s'intéresser aux premiers plissements corticaux.
Les neurones corticaux sont engendrés au niveau de l'épithélium péri-ventriculaire depuis lequel ils migrent vers la périphérie du cerveau pour former les couches corticales [47, 62, 63, 29, 30]. La manière dont se différencient les diverses aires corticales est encore loin d'être claire. Deux grandes voies semblent susceptibles d'apporter des explications. La première suppose l'existence d'une « protocarte » au niveau de l'épithélium qui se projetterait directement sur la surface corticale [62]. En effet, 90% des neurones migrent radialement le long de guides constitués par les cellules gliales. La seconde voie table sur une différentiation beaucoup plus tardive engendrée par des processus de régulation liés par exemple à l'arrivée des afférences thalamiques et corticales [51]. Il faut d'ailleurs noter que la mise en place précise de la connectivité semble résulter d'un processus de croissance axonale exubérante suivi d'une sélection par l'expérience [8, 27].
Après la migration des derniers neurones, la surface du cortex est toujours complètement lisse. L'hétérogénéité cytoarchitectonique est quasiment inexistante. C'est alors que débute la gyrogenèse proprement dite qui va conduire certaines régions du cortex à devenir des fonds de sillons et d'autres des sommets de gyri [81]. Les processus à l'oeuvre sont multiples et leur description dépasse le cadre de cet article. Leurs potentielles relations avec la différentiation des aires corticales sont actuellement inconnues. Parmi les processus impliqués, on peut noter par exemple une extension beaucoup plus importante du volume de la neuropile du cortex progyral comparativement à celle du cortex sulcal. Ces divers processus donnent lieu aux premiers plissements corticaux.
Topographie des racines sulcales du cortex
La topographie et la chronologie d'apparition des premiers plis semblent particulièrement constantes d'un individu à l'autre [12]. Leur identification serait donc non ambiguë, à la différence de celle des sillons chez l'adulte. Par la suite, nous nommerons ces premiers plis les racines sulcales. Une synthèse de la littérature embryologique nous a permis de proposer un premier schéma de l'ensemble de ces racines qui s'avère dual de celui des plis de passage (cf . Fig 7) [64]. Les processus de croissance ultérieurs vont noyer ce schéma initial pour conduire à la topographie particulièrement variable observée chez l'adulte. Cette complexité est donc induite avant tout par la variabilité des connexions superficielles survenant entre les racines sulcales, liée au caractère plus ou moins superficiel des plis de passage, et par l'apparition tardive de plissements secondaires de moindre profondeur.
Notre hypothèse revient donc à considérer que l'agencement topographique des différentes aires corticales est stable d'un individu à l'autre, mais qu'en revanche, les tailles relatives de ces aires peuvent varier considérablement. Cette variabilité serait alors à l'origine de la variabilité observée au niveau du plissement cortical. En effet, c'est la croissance importante d'une région corticale vers et par-dessus une région voisine à croissance plus modeste qui est à l'origine du mécanisme d'operculisation qui provoque l'enfouissement de cette dernière dans les profondeurs du cortex. On peut également considérer que la croissance importante d'une région corticale est susceptible d'engendrer des plissements secondaires qui n'apparaissent pas chez les individus pour lesquels cette expansion est plus faible.
Une vision générique de la topographie sulco-gyrale du cortex
Le point de vue décrit dans les chapitres précédents nous a conduits à proposer une description générique de la topographie sulco-gyrale susceptible d'expliquer n'importe quelle topographie individuelle. Cette description remet en question la nomenclature usuelle dans le sens où l'entité élémentaire dans ce modèle n'est plus le sillon mais la racine sulcale. Les sillons usuellement décrits correspondent alors au schéma de connexion superficiel entre les racines le plus fréquent. Le modèle proposé est évidemment loin d'être validé, il est d'ailleurs fort probable qu'il soit considérablement remis en question dans les années à venir. En revanche, l'idée de s'intéresser à des entités plus élémentaires que celles habituellement décrites nous semble fondamentale. Elle seule permet de s'affranchir réellement des difficultés auxquelles se trouvent actuellement confrontées les méthodes de normalisation spatiale. En outre, cette démarche ouvre la voie vers une indexation sulco-gyrale de l'organisation fonctionnelle beaucoup plus précise que celle proposée par les descriptions usuelles.
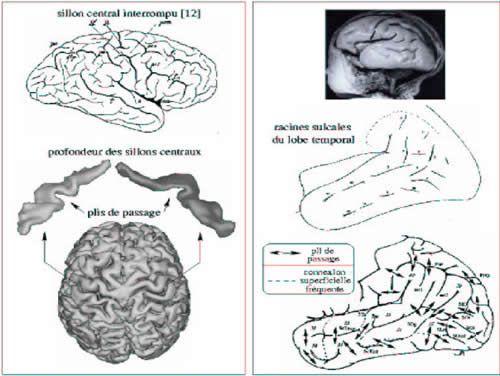
Fig 7 : Gauche : accéder aux formes des profondeurs du cortex modifie radicalement la perception de la variabilité inter-individuelle de la topographie sulco-gyrale. Par exemple, l'interruption d'un sillon peut être interprétée comme l'émergence à la surface d'un gyrus généralement profondément enfoui nommé pli de passage. De ce point de vue, le sillon central est composé de deux entités qu'il est toujours possible de définir, qu'il soit interrompu ou non. Droite : les premiers plissements corticaux, nommés racines sulcales, présentent une topographie et une chronologie d'apparition particulièrement similaires d'un individu à l'autre. Durant les stades ultérieurs de la croissance du cerveau, le plissement du cortex s'accentue, ce qui provoque diverses connexions entre les racines. La variabilité de ces connexions entre les individus peut être attribuée au développement plus ou moins important des plis de passage.
7) De nouvelles opportunités pour l'imagerie cérébrale
Outre les évolutions pressenties dans les chapitres précédents, le développement rapide des modalités d'imagerie destinées à l'étude de l'organisation cérébrale offre de nouvelles opportunités qui pourraient radicalement modifier la manière d'aborder la cartographie.
Une cartographie fonctionnelle incrémentale
Les potentialités de l'IRMf ont ouvert la voie à une nouvelle manière d'aborder les problèmes de cartographie qui n'implique plus l'utilisation d'un système de coordonnées. Ainsi, les protocoles visuels sont aujourd'hui souvent composés de deux phases [74]. La première vise à mettre en évidence une parcellisation fonctionnelle connue des aires primaires. La seconde aborde une question nouvelle dont l'analyse intègre la parcellisation issue de la première étape. Cette démarche constitue une évolution méthodologique importante puisqu'elle se rapproche considérablement du point de vue structurel usuel dans les neurosciences : une parcellisation remplace le système de coordonnées. Il faut noter que cette parcellisation fonctionnelle est encore très partielle puisqu'elle ne recouvre pas la totalité de la surface corticale à la différence des parcellisations architectoniques.
La mise en évidence rapide d'un grand nombre d'aires visuelles repose sur une propriété de type quasi architectural : la rétinotopie observée dans les aires les plus primaires. Il est peu probable que des propriétés communes à plusieurs aires puissent ainsi permettre de parcelliser rapidement toutes les régions du cortex, mais le principe d'une approche incrémentale de la cartographie reste utilisable puisqu'on peut multiplier les acquisitions chez un même sujet. Cette manière d'aborder la cartographie est prometteuse et souhaitable si on veut passer outre certaines des difficultés induites par les problèmes de normalisation spatiale.
La connectivité fonctionnelle basée sur le modèle cognitif
Depuis quelques années, une nouvelle problématique fondée sur l'imagerie fonctionnelle d'activation se développe. Il s'agit de chercher à inférer de la dynamique du signal fonctionnel des informations sur la connectivité du modèle cognitif étudié. Les méthodes mises en oeuvre peuvent reposer sur des analyses multivariées ou travailler directement dans l'espace des corrélations entre pixels [24, 81, 82]. On commence également à voir se développer des méthodes d'analyse s'appuyant directement sur des connaissances ou des hypothèses a priori sur la connectivité du modèle cognitif [7]. On observe donc un effort considérable pour intégrer le modèle cognitif plus directement dans la méthodologie mise en oeuvre pour le tester par rapport aux données. On notera enfin l'apparition d'une nouvelle technique visant à accéder à la connectivité d'une région en la stimulant magnétiquement [52]. Il semble ainsi possible d'induire une activation dans les régions connectées à la région stimulée.
Imagerie de la connectivité anatomique
Simultanément à ce regain d'intérêt pour la connectivité est apparue l'imagerie du tenseur de diffusion [2] qui ouvre la voie vers une observation de la connectivité anatomique in vivo. Nous avons montré récemment au SHFJ la possibilité de suivre par exemple un faisceau de fibres depuis les aires motrices primaires jusqu'au tronc cérébral (cf. Fig. 8) [57]. Des progrès restent à accomplir en termes de résolution spatiale avant d'accéder à la connectivité cortico-corticale, mais de tels progrès semblent techniquement envisageables. L'imagerie de diffusion pourrait radicalement modifier à l'avenir la manière d'aborder les études fonctionnelles puisque pour la première fois nous aurions accès à des informations architecturales in vivo. On imagine alors aisément les conséquences aussi bien au niveau de l'étude de la connectivité des modèles cognitifs qu'à travers une définition anatomique de certaines aires corticale dont la connectivité est connue a priori. Il faut d'ailleurs réaliser que les connaissances actuelles sur la connectivité du cortex humain sont encore très partielles.
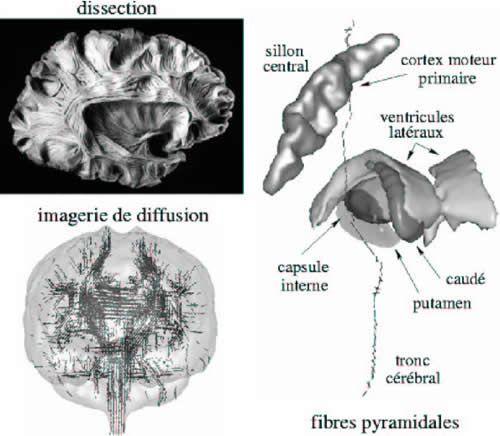
Fig 8 : A l'heure actuelle, aucune méthode ne permet d'accéder à la connectivité du cerveau in vivo. Le développement récent de l'imagerie du tenseur de diffusion des molécules d'eau, qui permet d'accéder à la direction des fibres axonales, pourrait radicalement modifier la situation. Il est pour l'instant possible de suivre la direction des fibres des plus grands faisceaux. Des progrès prévisibles en résolution pourraient permettre dans un avenir proche d'accéder à la connectivité corticocorticale.
8) Conclusion
Nous devrions assister dans les prochaines années à un rapprochement entre les méthodologies mises en oeuvre en imagerie fonctionnelle et la culture usuelle des spécialistes des neurosciences. Ce rapprochement passe par un changement de point de vue dans la manière d'aborder le traitement des données. Il s'agit en effet d'intégrer aux traitements des informations structurelles d'origines architecturale ou cognitive. Le type de transition nécessaire au niveau des algorithmes est relativement classique dans le monde du traitement d'images et plus particulièrement dans celui de la vision par ordinateur. Il est en effet lié à un des paradigmes de la vision qui consiste à passer des images brutes à la reconnaissance des objets par l'intermédiaire de représentations structurelles [44]. Une image brute est d'abord réduite à un graphe représentant synthétiquement l'agencement de diverses informations locales extraites par des filtres (segments, taches, coins...). Cette représentation est alors confrontée à des représentations structurelles connues a priori des objets à identifier.
Nous cherchons donc à développer au SHFJ une méthodologie de cartographie fonctionnelle fondée non plus sur les points des images mais sur des objets préalablement extraits des images (subdivisions anatomiques, activations fonctionnelles). Ces objets sont assemblés dans des structures décrivant leurs relations respectives. Ces structures peuvent alors être confrontées aux modèles a priori anatomiques ou cognitifs, eux aussi représentés sous forme structurelle. Cette démarche se veut clairement complémentaire de la démarche statistique classique puisqu'elle entend s'appuyer sur les cartes paramétriques individuelles issues de SPM pour ce qui concerne la détection des activations.
Il faut noter que le parallèle entre les algorithmes à mettre en oeuvre pour la cartographie fonctionnelle et les problèmes de la vision artificielle n'est pas surprenant. En effet, la cartographie fonctionnelle implique d'incessantes mises en correspondance entre images et modèles a priori structurels. Une différence notoire, qui explique d'ailleurs la difficulté avec laquelle nous manipulons les images fonctionnelles, réside dans l'aspect volumique du signal (l'homme ne dispose malheureusement pas de capteur volumique...). Le problème de la vision artificielle classique repose lui sur une approche de type stéréovision à partir de deux ou trois caméras, semblable à la vision biologique.
Remerciements :
Le travail décrit dans cet article a bénéficié du soutien du GIS Sciences de la Cognition, de la mission pour le développement de l'innovation participative (délégation générale pour l'armement), et de la société Elekta.
Références :
[1] Ayache N, L'analyse automatique des images médicales : Etat de l'art et perspectives, Annales de l'Institut Pasteur
[2] Basser PJ, Mattiello J, LeBihan D (1994), MR diffusion tensor spectroscopy and Imaging, Biophysical Journal 66, 259-267
[3] Belin P, Régis J, Mangin JF, et al. (1995), Functional localization of hand sensorimotor cortical maps : constant topographic relationships with the 3D arrangement of the central and adjacent cortical sulci, Neurology 45(4), A324
[4] Braak H (1980), Architectonics of the human telencephalic cortex, Berlin, Springer Verlag
[5] Broca P (1861), Perte de la parole, ramollissement chronique et destruction partielle du lobe antérieur gauche du cerveau, Bull. Soc. Anthropol. 2, 235-239
[6] Brodmann K (1909), Vergleichende Lokalisationslehre des Grosshirnrinde, Leipzig : Verlag Barth
[7] Büchel C, Friston K (1997), Modulation of Connectivity in visual pathways by attention: cortical interactions evaluated with structural equation modelling and fMRI, Cerebral Cortex 7, 768-778
[8] Changeux JP (1983), L'homme neuronal, Fayard
[9] Coulon O, Bloch I, Frouin V, Mangin JF (1997), Multiscale measures in linear scale-space for characterizing cerebral functional activations, In Scale-Space'97, Utrecht, vol. 1252 of LNCS, Springer Verlag, 188-199
[1] Coulon O, Bloch I, Frouin V, Poline JB, Mangin JF (1998), Group analysis of individual activation maps: comparison of 3D scale-space primal sketches using a Markovian random field, In HBM'98, Montréal, NeuroImage, 7(4), S606
[2] Crozier S, Mangin JF, Leherecy S et al. (1998), Correlation between vascular lesions and sulcogyral anatomy, HBM'98, Montréal, NeuroImage, 7(4), S464
[3] Cunningham DJ (1892), Contribution to the surface anatomy of the cerebral hemispheres, Royal Irish Academy
[4] Dehaene S (1997), La bosse des maths, Odile Jacob
[5] Dehaene S, Dupoux E, Mehler J, et al. (1997), Anatomical variability in the cortical representation of first and second languages, NeuroReport
[6] Di Virgilio G, Clarke S (1997), Direct interhemispheric visual input to human speech areas, Human Brain Mapping 5, 347-354
[7] Drury HA, VanEssen DC, Anderson CH, Lee CW, Coogan TA, Lewis JW (1995), Computerized mappings of the cerebral flattening method and a surface-based coordinate system, J. Cognitive Neurosciences 8, 1-28, http://v1.wustl.edu
[8] Duvernoy HM (1992), Le cerveau humain. Surface, coupes sériées tridimensionnelles et IRM, Springer Verlag
[9] Ferrier D (1875), Experiments on the brain of monkeys, Proc. R. Soc. London 23, 409-430
[10] Flechsig P (1920), Anatomie des menschlichen Gehirns und Rückenmarks, Thieme Verlag
[11] Fox P, Perlmutter J, Raichle M (1985), A stereotactic method of anatomical localization for PET, J. Comput. Assist. Tomogr. 9, 141-153
[12] Fox P, Mikinen S, Davis G, Lancaster JL (1994), Brainmap: a database of human functional mapping. Functional Neuroimaging: Technical Foundations, Academic Press, 95-105, http://biad63.uthscsa.edu/services
[13] Frackowiak RSJ, Friston K, Frith C, Dolan R, Mazziota J, Human Brain Function, Academic Press, 1997, http://www.fil.ion.bpmf.ac.uk/spm/
[23] Friston K, Ashburner J, Poline JB, Frith CD, Heather JD, Frackowiak RSJ (1995), Spatial realignment and normalisation of images, Human Brain Mapping 2, 165-189
[24] Friston K, Poline JB, Strother S, Holmes A, Frith C, Frackowiak R (1996), A multivariate analysis of PET activation studies, Human Brain Mapping 4, 140-151
[25] Gazzaniga M (1985), Le cerveau social, Odile Jacob
[26] Geyer S, Ledberg A, Schleicher A, et al. (1996), Two different areas within the primary motor cortex of man, Nature 382, 805-807
[27] Innocenti GM (1995), Exuberant development of connections, and its possible permissive role in cortical evolution, Trends Neurosci., 18(9), 397-402
[28] Jeannerod M (1996), De la physiologie mentale, Odile Jacob
[29] Killackey HP (1990), Neocortical expansion : an attempt toward relating phylogeny and ontogeny, J Cogn. Neurosc. 2(1), 1-17
[30] Killackey HP, Rhoades RW, Bennet-Clarke CA (1995), The formation of a cortical somatotopic map, Trends Neurosci. 18(9), 402-407
[3 1 ] Krubitzer L (1995), The organization of neocortex in mammals: are species differences really so different ?, Trends Neurosci. 18(9), 408-417
[32] Le Goualher G, Barillot, Bizais Y (1997), Three-dimensional segmentation and representation of cortical sulci using active ribbons, Int. J. of Pattern Recognition and Artificial Intelligence 11(8)
[33] Le Goualher G, Procyk E, Collins L, Petrides M, Evans AC, Sulcus extraction and automatic labelling (SEAL) : I Method for mapping of sulcal neuroanatomy (1998), HBM'98, Montréal, NeuroImage 7(4) , S729
[34] Lehericy S, Duffau H, Cornu P et al. (1998), Presurgical fMRI mapping of cortical motor areas in patients with brain tumors : comparison with intrasurgical stimulation, HBM'98, Montreal, Neuroimage 7(4), S457
[35] Lobel E, Berthoz A, Leroy-Willig A, LeBihan D (1996), fMRI study of voluntary saccadic eye movements in humans, Neuroimage 3, S396
[36] Lohmann G, Von Cramon DY (1998), Automatic detection and labelling of the human cortical folds in magnetic resonance data sets, ECCV'98, Freiburg
[37] Manceaux-Demiau A, Mangin JF, Régis J, Pizzato O, Frouin V (1997), Differential features of cortical folds, CVRMed/MRCAS, Grenoble, vol 1205 of LNCS, Springer-Verlag, pp 439-448 [3 8] Mangin JF, Frouin V, Bloch I, Bendriem B, Lopez-Krahe J (1994), Fast nonsupervised registration of PET and MR images of the brain, J. Cereb Blood Flow Metab 14, 749-762
[39] Mangin JF, Frouin V, Bloch I, Régis J, Lopez-Krahe J (1995), From 3D magnetic resonance images to structural representations of the cortex topography using topology preserving deformations, J. Mathematical Imaging and Vision 5, 297-318
[40] Mangin JF, Régis J, Bloch I, Frouin V, Samson Y, Lopez-Krahe J (1995), A Markovian random field based random graph modelling the human cortical topography, CVRMed'95, Nice, vol 905 of LNCS, Springer Verlag, 177-183
[41] Mangin JF, Régis J, Frouin V (1996), Shape bottlenecks and conservative flow systems, IEEE/SIAM Workshop on Mathematical Methods in Biomedical Image Analysis, San Francisco, 319- 328
[42] Mangin JF, Régis J, Poupon C et al. (1998), The duality between sulcal roots and U-fiber bundles investigated via tensor diffusion imaging, HBM'98, Montréal, NeuroImage 7(4) , S701
[43] Mangin JF, Coulon O, Frouin V (1998), Robust brain segmentation using histogram scale-space analysis and mathematical morphology, MICCAI, MIT, to appear in LNCS, Springer Verlag
[44] Marr D (1982), Vision, MIT Press, Cambridge
[45] Mazziotta J, Toga AW, Evans A, Fox P, Lancaster J (1995), A probabilistic atlas of the human brain: theory and rationale for its development, NeuroImage 2, 89-101, http://www.loni.ucla.edu
[46] Miller M, Christensen GE, Amit Y, Grenander U (1993), A mathematical textbook of deformable neuroanatomies, Proc. Natl. Acad. Sci USA 90:11944-11948,
http://www.cis.wustl.edu/wu research/brain.html
[47] Mountcastle VB (1997), The columnar organization of the neocortex, Brain 120, 701-722
[48] Nieuwenhuys R, Voogd J, Vah Huijzen C (1988), The human central nervous system. A synopsis and atlas, Springer Verlag
[49] Northcutt RG, Kaas JH, The emergence and evolution of mammalian neocortex (1995), Trends Neurosci. 18(9), 373-379
[50] O'Leary DDM (1989), Do cortical areas emerge from a protocortex ?, Trends Neurosci. 12(10), 400-406
[51] Ono M, Kubik S, Abernathey CD (1990), Atlas of the cerebral sulci, Thieme Verlag
[52] Paus T, Jech R, Thompson CJ, et al. (1997), Transcranial magnetic stimulation during positron emission tomography : a new method for studying connectivity of the human cerebral cortex, J Neurosci. 17, 3178-3184
[53] Penfield W, Rasmussen T (1950), The cerebral cortex of man, Macmillan
[54] Petrides M, Pandya DN (1994), Comparative analysis of the human and the macaque frontal cortex, Handbook of Neuropsychology 9, 17-57
[55] Poline JB, Mazoyer B (1993), Analysis of individual positron emission tomography activation maps by high signa to noise ratio pixel cluster detection, J. Cereb. Blood Flow Metab. 13, 425-437
[56] Poline JB, Mazoyer B (1994), Analysis of individual brain activation maps using hierarchical description and multi-scale detection, IEEE Trans. Med. Imag. 13, 702-710
[57] Poline JB, Worsley KJ, Evans AC, Friston KJ (1997), Combining spatial extent and peak intensity to test for activations in functional imaging, NeuroImage 5, 83-96
[58] Poupon C, Mangin JF, Frouin V, et al. (1998), Regularization of MR diffusion tensor maps for tracking brain white matter bundles, MICCAI, MIT, to appear in LNCS, Springer Verlag
[59] Poupon F, Mangin JF, Hasboun D, Poupon C, Magnin I, Frouin V (1998), Multi-object deformable templates dedicated to the segmentation of brain deep structures, MICCAI, MIT, to appear in LNCS, Springer Verlag
[60] Procyk E, Petrides M, Le Goualher G, Collins L, Evans AC (1998), Sulcus extraction and automatic labelling (SEAL) : II Generation of frontal sulci probabilistic 3D maps, HBM'98, Montréal, NeuroImage 7(4) , S730
[61] Rajkowska G, Goldman-Rakik PS (1995), Cytoarchitectonic definition of prefrontal areas in the normal human cortex : II. Variability in locations of areas 9 and 46 ans relationship to the Talairach coordinate system, Cerebral Cortex 5, 323-337
[62] Rakik P (1988), Spécification of cerebral cortical areas, Science 241, 170-176
[63] Rakik P (1995), Corticogenesis in Human and Nonhuman Primates, The Cognitive Neurosciences, M. Gazzaniga Ed., MIT Press
[64] Régis J (1994), Anatomie sulcale profonde et cartographie fonctionnelle du cortex cérébral, Thèse de Médecine, Marseille
[65] Régis J, Mangin JF, Frouin V, Sastre F, Peragut L, Samson Y (1995), Cerebral cortex generic model for cortical localization and preoperative multimodal integration in epilepsy surgery, Stereotactic and Functional Neurosurgery 65, 72-80
[66] Remy P, Samson Y, Hantraye P et al. (1995), Clinical correlates of 18F-fluorodopa in five grafted parkinsonian patients, Annals of Neurology 38(4), 580-588
[67] Roland PE, Zilles K (1994), Brain atlases-A new research tool, Trends Neurosci. 17, 458-467
[68] Royackkers N, Fawal H, Desvignes M, Revenu M, Travère JM (1995), Feature extraction for cortical sulci identification, 9th SCIA, Uppsala, 1147-1154
[69] Sarkisov SA et al. (1955), Atlas of the Cytoarchitectonics of the Human Cerebral Cortex, Medgiz
[70] Semah F, Baulac M, Hasboun D et al. (1995), Is interictal temporal hypometabolism related to mesial temporal sclerosis ? A positron emission tomography/magnetic resonance imaging confrontation, Epilepsia, 36(5), 447-456
[71] Szikla G, Bouvier G, Hori T, Petrov V (1977), Angiography of the human brain cortex, Springer Verlag
[72] Talairach J, Szikla G, Tournoux P, Prosalentis A, Bordas-Ferrier M (1967), Atlas d'anatomie stéréotaxique du téléencéphale, Masson
[73] Talairach J, Tournoux P (1988), Coplanar stereotaxic atlas of the human brain. 3-dimensional proportional system : an approach to cerebral imaging, Thieme Verlag
[74] Thompson PM, Schwartz C, Toga AW (1996), High-resolution random mesh algorithms for creating a probabilistic 3D surface atlas of the human brain, Neuroimage 3, 19-34
[75] Tootel R, Dale A, Sereno M, Malach R ( 1996), New images from human visual cortex, Trends Neurosci. 19, 481-489
[76] Tzourio N, Petit L, Mellet E et al. (1997), Use of anatomical parcellisation to catalog and study structure-function relationships in the human brain, NeuroImage 5(4), 228-233
[77] Van Essen DC, Deyoe EA (1995), Concurent processing in the primate visual cortex, The Cognitive Neurosciences, M. Gazzaniga Ed., MIT Press
[78] Van Essen DC (1997), A tension-based theory of morphogenesis and compact wiring in the central nervous system, Nature 385, 313-318
[79] Von Economo C (1929), The cytoarchitectonics of the human cortex, Oxford University Press
[80] Watson JDG, Myers R, Frackowiak RSJ, et al. (1993), Area V5 of the human brain : evidence from a combined study using positron emission tomography and magnetic resonance imaging, Cerebral Cortex 3, 79-94
[81] Welker W (1988), Why does cerebral cortex fissure and fold, Cerebral Cortex, vol. 8B, Plenium Press, 3-135
[82] Worsley K, Poline JB, Friston K, Evans A (1997), Characterizing the response of PET and fMRI data using multivariate linear models, NeuroImage 6(4), 305-319
[83] Worsley K, Cao J, Paus T, Petrides M, Evans A (1998), Detecting functional connectivity by thresholding correlation random fields, HBM'98, Montreal, Neuroimage 7(4), S36
[84] Yasargil MG (1994), Microneurosurgery IV A, Georg Thieme Verlag
[85] Young MP, Scannel JW, Burns G (1995), The analysis of cortical connectivity, Springer Verlag
[86] Yousry TA, Schmid, Alkadhi H, et al. (1997), Localization of the motor hand area to a knob on the precentral gyrus : a new landmark, Brain 120, 141-157
[87] Zeki S (1993), A vision of the brain, Blackwell Scientific Publications
[88] Zihl J, Von Cramon D, Mai N (1983), Selective disturbance of movement vision after bilateral brain damage, Brain 106, 313-340




