119. NEUROSCIENCES & PSYCHONEUROLOGIE.
Identifié, un lien génétique direct au TSA retrouvé
Résumé : Les chercheurs ont identifié un nouveau lien direct entre l'autisme et le gène SUV39H2.
Source: RIKEN
De nouvelles recherches du RIKEN Center for Brain Science (CBS) au Japon montrent qu'un déficit de la méthylation des histones pourrait conduire au développement de troubles du spectre autistique (TSA). Une variante humaine du gène SUV39H2 a conduit les chercheurs à examiner son absence chez la souris.
Publiée dans Molecular Psychiatry , l'étude a révélé qu'en leur absence, les souris adultes présentaient une inflexibilité cognitive similaire à ce qui se produit dans l'autisme, et les souris embryonnaires présentaient une expression mal régulée des gènes liés au développement du cerveau.
Ces résultats représentent le premier lien direct entre le gène SUV39H2 et les TSA.
Les gènes sont activés et désactivés tout au long de notre développement. Mais la variation génétique signifie que ce qui est désactivé chez certaines personnes reste activé chez d'autres. C'est pourquoi, par exemple, certains adultes peuvent digérer les produits laitiers et d'autres sont intolérants au lactose ; le gène de fabrication de l'enzyme lactase est désactivé lorsque certaines personnes deviennent adultes, mais pas d'autres. Une façon d'activer et de désactiver les gènes consiste à utiliser un processus appelé méthylation des histones dans lequel des enzymes spéciales transfèrent des groupes méthyle aux protéines d'histone qui sont enroulées autour de l'ADN.
Les variations des gènes liés à la méthylation au cours du développement du cerveau peuvent entraîner de graves problèmes. Une telle variation se produit dans une maladie rare appelée syndrome de Kleefstra, dans laquelle une mutation empêche la méthylation de H3K9, un emplacement spécifique de l'histone H3. Parce que le syndrome de Kleefstra ressemble à l'autisme à certains égards, les chercheurs de RIKEN CBS dirigés par Takeo Yoshikawa ont recherché des variations spécifiques à l'autisme dans les gènes qui peuvent modifier H3K9.
Parmi neuf de ces gènes, ils ont trouvé une variante dans un gène de la méthyltransférase H3K9 - SUV39H2 - qui était présent dans l'autisme, et le SUV39H2 muté a empêché la méthylation lorsqu'il a été testé en laboratoire. Des résultats de perte de fonction similaires ont été trouvés pour la version souris de la variante.
L'étape suivante consistait à voir ce qui se passe chez les souris dépourvues du gène Suv39h2 . Sur le plan comportemental, les chercheurs ont découvert que les souris pouvaient apprendre une tâche cognitive simple, mais avaient du mal lorsque la tâche nécessitait une flexibilité cognitive. Dans la tâche simple, les souris ont appris à obtenir une récompense en poussant une porte aux coins diagonaux alternés d'une cage. Après avoir bien fait cela, les emplacements de récompense possibles sont passés aux deux autres coins diagonaux. Les souris génétiquement modifiées l'ont fait ainsi que les souris de type sauvage.
Dans une autre tâche, après avoir appris à alterner entre les deux coins diagonaux, seul l'emplacement d'une récompense a été changé. Lorsque les souris ont été mises au défi d'alterner au hasard entre ces deux tâches, les souris de type sauvage ont pu s'adapter rapidement, mais les souris déficientes en Suv39h2 ont pris beaucoup plus de temps.
«Cette tâche d'apprentissage par inversion en série était essentielle», explique le premier auteur Shabeesh Balan. "L'inflexibilité cognitive est un symptôme essentiel du TSA, et notre nouvelle tâche a permis d'aborder cette caractéristique comportementale d'une manière que les études précédentes sur la souris ne pouvaient pas."
Lorsque les chercheurs ont examiné ce qui s'est passé dans le cerveau de la souris lorsque la méthylation de H3K9 ne s'est pas produite, ils ont découvert que des gènes importants qui sont généralement réduits au silence au début du développement étaient activés chez les souris expérimentales. « Suv39h2 est connu pour être exprimé au début du développement neurologique et pour méthyler H3K9 », explique Yoshikawa.
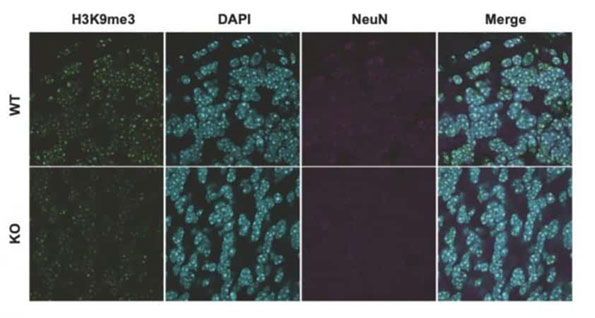
Les niveaux de méthylation de H3K9 dans le cervelet étaient plus faibles chez les souris déficientes en Suv39h2 que chez les souris témoins. Crédit : RIKEN
« Cela permet de contrôler les gènes qui devraient être désactivés. Mais sans cela, les gènes du groupe de protocadhérine β étaient anormalement exprimés à des niveaux élevés chez les souris embryonnaires. » Les protocadhérines étant essentielles à la formation des circuits neuronaux, les chercheurs pensent avoir trouvé une voie biologique importante qui pourrait être au cœur de plusieurs troubles du développement neurologique.
L'équipe a ensuite vérifié l'importance de SUV39H2 dans les TSA humains en constatant que son expression était plus faible dans le cerveau post-mortem des personnes atteintes de TSA que chez les témoins. « Ce qui a commencé par une mutation avec perte de fonction chez une seule personne atteinte de TSA », explique Yoshikawa, « a conduit à un paysage causal général pour les TSA qui aboutit à une anomalie des circuits cérébraux. »
Il a déjà été proposé que les protocadhérines soient liées à un large éventail de troubles mentaux. Cette étude montre que l'activation du gène SUV39H2 est une thérapie potentielle pour les troubles mentaux, y compris les TSA, qui devrait être étudiée de manière plus approfondie dans de futures études.
À propos de cette actualité sur la recherche en autisme et en génétique
Source : RIKEN
Contact : Adam Phillips – RIKEN
Image : L'image est créditée à RIKEN
Recherche originale : accès libre.
"Une variante de perte de fonction dans SUV39H2 identifiée dans le trouble du spectre autistique provoque une triméthylation H3K9 altérée et une dérégulation des gènes du cluster β de la protocadhérine dans le cerveau en développement" par Balan et al. Psychiatrie Moléculaire
Abstrait
Une variante de perte de fonction dans SUV39H2 identifiée dans le trouble du spectre autistique provoque une triméthylation H3K9 altérée et une dérégulation des gènes du cluster β de la protocadhérine dans le cerveau en développement
Des preuves récentes ont documenté les rôles potentiels des enzymes modifiant les histones dans les troubles du spectre autistique (TSA). La diméthylation aberrante de l'histone H3 lysine 9 (H3K9) résultant de variantes génétiques des histones méthyltransférases est connue pour les anomalies neurodéveloppementales et comportementales. Cependant, un examen systématique de la dynamique de méthylation de H3K9 dans les TSA fait défaut.
Ici, nous avons reséquencé neuf gènes pour les histones méthyltransférases et déméthylases impliquées dans la méthylation de H3K9 chez les personnes atteintes de TSA et les témoins sains à l'aide d'un séquençage ciblé de nouvelle génération.
Nous avons identifié une nouvelle variante rare (A211S) dans le SUV39H2 , qui était prédite comme délétère. Le variant a montré une activité histone méthyltransférase fortement réduite in vitro . L' analyse in silico a montré que le variant déstabilise le noyau hydrophobe et affecte allostériquement l'activité enzymatique. Les souris Suv39h2 -KO ont affiché une hyperactivité et une flexibilité comportementale réduite dans l'apprentissage des tâches nécessitant une adaptation comportementale complexe, ce qui est pertinent pour les TSA.
Le déficit Suv39h2 a évoqué une expression élevée d'un sous-ensemble de gènes de cluster de protocadhérine ( Pcdhb ) dans le cerveau embryonnaire, ce qui est attribuable à la perte de la triméthylation H3K9 (me3) au niveau des promoteurs de gènes. Une réduction de H3K9me3 a persisté dans le cervelet de souris déficientes en Suv39h2 jusqu'à un stade adulte. De manière congruente, une expression réduite de SUV39H1 et SUV39H2 dans les échantillons de cerveau post-mortem d'individus atteints de TSA a été observée, soulignant le rôle de la déficience en H3K9me3 dans l'étiologie des TSA.
La présente étude fournit des preuves directes du rôle de SUV39H2 dans les TSA et suggère une cascade moléculaire de dysfonctionnement de SUV39H2 conduisant à une déficience en H3K9me3 suivie d'une expression intempestive et élevée des gènes du cluster Pcdhb au début du développement neurologique.
Aout 2021



