173. NEUROSCIENCES & GENETIQUE
Nouvelles découvertes sur l'origine du système immunitaire du cerveau
Résumé : De nouvelles découvertes révèlent que les phagocytes ne mûrissent complètement qu'après la naissance, ce qui contredit les hypothèses précédentes selon lesquelles ils mûrissent au cours du développement embryonnaire.
Source: Université de Fribourg
Ce qui entre dans le cerveau et ce qui n'y entre pas est strictement réglementé. Des chercheurs de la Faculté de médecine de l'Université de Fribourg ont étudié les phagocytes qui recouvrent les vaisseaux sanguins du cerveau et renforcent la barrière hémato-encéphalique.
Comme l'ont montré les scientifiques de l'Institut de neuropathologie du Centre médical de l'Université de Fribourg avec une équipe de recherche internationale, ces cellules ne mûrissent pleinement qu'après la naissance selon un programme de développement défini étape par étape.
Jusqu'à présent, on supposait que ce processus se terminait au cours du développement embryonnaire.
Leurs études, publiées dans la revue Nature le 20 avril 2022, ont d'abord été menées sur des lignées de souris génétiquement modifiées et ont été confirmées sur des échantillons humains. On s'attend à ce qu'ils fournissent des informations importantes sur le développement et le traitement des maladies du cerveau.
« Nous avons pu montrer que les cellules immunitaires que nous avons étudiées migrent de la membrane cérébrale vers les vaisseaux sanguins du cerveau peu avant la naissance et y mûrissent. Ce processus ne s'achève probablement que quelques semaines après la naissance et pourrait en partie expliquer pourquoi le cerveau est si vulnérable au début de la vie », déclare le professeur Dr Marco Prinz, directeur médical de l'Institut de neuropathologie du Centre médical de l'Université de Fribourg. et responsable du Collaborative Research Center/Transregio 167—NeuroMac et membre du Cluster of Excellence CIBSS -Centre for Integrative Biological Signalling Studies à l'Université de Fribourg.
"Le moment tardif de la maturation des phagocytes, également appelés macrophages, nous a beaucoup surpris, car les cellules précurseurs sont déjà présentes dans le cerveau bien avant", explique Prinz.
De plus, les scientifiques ont pu montrer pour la première fois que les vaisseaux, en tant que cellules structurantes du cerveau, envoient des signaux importants pour le développement normal des macrophages du cerveau.
La barrière hémato-encéphalique est formée de cellules sur les vaisseaux sanguins du cerveau. Ils contrôlent quelles substances peuvent entrer dans le cerveau et lesquelles ne le peuvent pas. Cela protège le cerveau des substances nocives et des agents pathogènes. La barrière hémato-encéphalique est particulièrement perméable dans le cas de maladies infectieuses, de certaines tumeurs cérébrales et d'un manque d'oxygène.
Signification pour la maladie d'Alzheimer, la sclérose en plaques et plus encore
« En plus de la barrière hémato-encéphalique, les cellules immunitaires que nous avons étudiées contrôlent ce qui peut atteindre les cellules cérébrales à partir du sang, elles mangent des agents pathogènes et préviennent une inflammation excessive. Ils sont également impliqués dans le développement du cancer, de la maladie d'Alzheimer et de la sclérose en plaques. Nos découvertes pourraient être importantes pour une meilleure compréhension de ces maladies et des thérapies futures », ajoute Prinz.
Cellules codées par couleur et analyses de gènes
Pour leur étude, les chercheurs dirigés par les deux premiers auteurs, le Dr Takahiro Masuda de l'Université de Kyushu, au Japon, et le Dr Lukas Amann de la Faculté de médecine de l'Université de Fribourg ont utilisé plusieurs lignées de souris nouvellement établies.
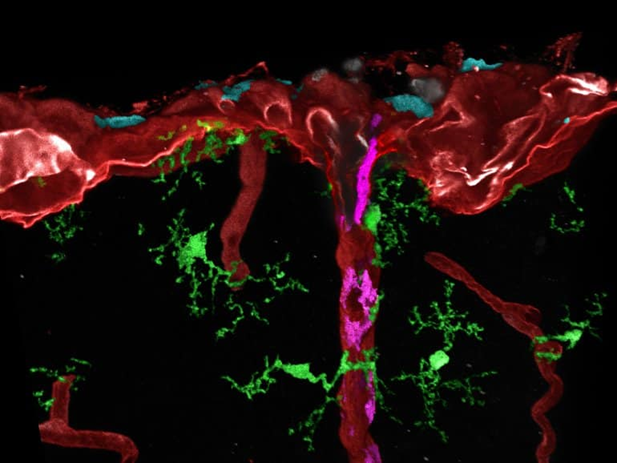
Image microscopique post-traitée de différents macrophages tissulaires (cyan, magenta ou vert) dans le cerveau de souris. Crédit : Centre médical - Université de Fribourg / Dr Lukas Amann
Avec ceux-ci, différents types de macrophages cérébraux et leurs cellules progénitrices pourraient être spécifiquement marqués pour la première fois et plus tard trouvés dans les différentes régions du cerveau à l'aide d'une microscopie à haute résolution. De plus, ils ont examiné l'activité génique de cellules individuelles et ont ainsi déterminé leur degré de maturité.
« Nous avons également pu confirmer les données sur les cerveaux humains. Cela nous donne une compréhension beaucoup plus profonde de la synchronisation et des mécanismes moléculaires dans le développement des cellules. Ces connaissances peuvent désormais être utilisées pour explorer de nouvelles approches thérapeutiques plus spécifiques pour les maladies du cerveau », explique le biologiste Dr Lukas Amann, qui travaille à l'Institut de neuropathologie du Medica Center de l'Université de Fribourg.
À propos de cette actualité de la recherche en neurosciences
Auteur : Service de presse
Source : Université de Fribourg
Contact : Service de presse – Université de Fribourg
Image : L'image est créditée à l'Université de Fribourg / Dr. Lukas Amann
Recherche originale : Accès fermé.
« La spécification des sous-ensembles de macrophages du SNC se produit après la naissance dans des niches définies » par Lukas Amann et al. Nature
Abstrait
La spécification des sous-ensembles de macrophages du SNC se produit après la naissance dans des niches définies
Tous les macrophages résidant dans les tissus du système nerveux central (SNC) - y compris la microglie parenchymateuse, ainsi que les macrophages associés au SNC (CAM) tels que les macrophages méningés et périvasculaires - font partie du système immunitaire inné endogène du SNC qui agit comme première ligne de défense lors d'infections ou de traumatismes.
Il a été suggéré que la microglie et tous les sous-ensembles de CAM sont dérivés de sources cellulaires prénatales dans le sac vitellin qui ont été définies comme des progéniteurs érythromyéloïdes précoces.
Cependant, les relations ontogénétiques précises, les programmes transcriptionnels sous-jacents et les signaux moléculaires qui conduisent le développement de sous-ensembles CAM distincts in situ sont mal compris.
Ici, nous montrons, à l'aide de systèmes de cartographie du destin, de profilage unicellulaire et de mutants spécifiques aux cellules, que seuls les macrophages méningés et la microglie partagent un progéniteur prénatal commun.
En revanche, les macrophages périvasculaires proviennent des macrophages méningés périnatals seulement après la naissance d'une manière dépendante des intégrines. L'établissement de macrophages périvasculaires nécessite de manière critique la présence de cellules musculaires lisses vasculaires artérielles.
Ensemble, nos données révèlent un processus précisément chronométré dans des niches anatomiques distinctes pour l'établissement de sous-ensembles de macrophages dans le SNC.
Mai 2022




